Acta Médica. 2018; 19(3)
ARTÍCULO
ORIGINAL
Caracterización de los linfomas no Hodgkin con afectación del sistema nervioso
Calixto Hernández Cruz1, Sheila M. Pino Linares1,
Aliette García García1, José Carnot Uria1,
Jorge Muñío Perurena1, Kali Cepero Llauger1,
Ibis K. Pardo Ramírez1, Oliday Ríos Jiménez1
1Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción:
Los linfomas no Hodgkin forman un grupo de enfermedades neoplásicas de
origen linfoide, pudiendo afectar al sistema nervioso de forma primaria o secundaria.
Objetivo:
Caracterizar a los linfomas no Hodgkin con infiltración del sistema nervioso.
Métodos:
Se realizó un estudio descriptivo en 26 pacientes con diagnóstico
de linfoma no Hodgkin y afectación del sistema nervioso tratados en el
Servicio de Hematología del Hospital Clínico Quirúrgico "Hermanos
Ameijeiras", desde el año 2000 hasta el año 2016.
Resultados: Del total de pacientes, 14 (53,85 %) presentaron infiltración
primaria y 12 (46,15 %) secundaria. La incidencia fue ligeramente mayor en el
sexo masculino y en los mayores de 60 años. Predominaron los linfomas no
Hodgkin agresivos. La localización más frecuente de forma general
fue la cerebral con 12 casos (46,15 %), seguido de la leptomeníngea con
8 casos (30,77 %). Los primarios generalmente fueron diagnosticados en el estadio
l, 9 (64,29 %) y los secundarios en estadio lV, 8 (66,67 %). Predominaron los
pacientes sin síntomas B al debut 16 (61,54 %). Según el índice
de pronóstico internacional, el 50 % fue estratificado en el grupo pronóstico
alto intermedio. La remisión completa obtenida de forma global fue del
26,92 %. Las mejores respuestas terapéuticas se obtuvieron con las altas
dosis de metotrexato en monoterapia o en combinación con otra quimioterapia.
La supervivencia libre de enfermedad y la supervivencia global a los 5 años
fueron de un 18 % y 23,5 % respectivamente.
Conclusiones: Las características clínicas de la presente muestra
coinciden con lo reportado previamente. Los resultados terapéuticos resultaron
pobres independientemente del esquema empleado y con una baja supervivencia
libre de enfermedad y global a los 5 años.
Palabras clave: Linfomas no Hodgkin; infiltración; sistema nervioso.
INTRODUCCIÓN
Los linfomas no Hodgkin (LNH) forman un grupo heterogéneo de enfermedades neoplásicas de origen linfoide. Estos procesos linfoproliferativos malignos son tumores de carácter clonal provenientes de células B, células T o células natural killers (NK) en distintos estadios de diferenciación.1,2
Para el abordaje certero de la enfermedad en su debut es necesario un apropiado diagnóstico histopatológico, basados en la clasificación de la OMS; una correcta estadiación, según los criterios de Ann Arbor; así como una apreciación de los elementos de mal pronóstico presentes, evaluados de acuerdo al índice pronóstico internacional (IPI).3-5
En nuestro país, el cáncer como causa de muerte ha ido aumentando en los últimos años. La incidencia de los LNH también se ha incrementado en este contexto, con un total de 660 nuevos casos reportados en el año 2011 en Cuba.6 Un 50 % de ellos desarrollarán una enfermedad extraganglionar (enfermedad extranodal secundaria), mientras que entre el 10 y el 35 % tendrán un linfoma extranodal primario al diagnóstico; siendo la toma del sistema nervioso (SN) una de las más temidas por lo complejo de su manejo y su pronóstico adverso en general.6-8
Los linfomas no Hodgkin pueden infiltrar el sistema nervioso central (SNC) bien como única área de la enfermedad (linfoma primario del SNC [LPSNC]) o como propagación secundaria.9 Los casos primarios se definen como una enfermedad limitada al SNC, sin compromiso de otras áreas al diagnóstico, afectando encéfalo, meninges, globo ocular o médula espinal.10,11 En tanto, la toma secundaria puede ocurrir en cualquiera de las estructuras nerviosas, ya sean centrales o periféricas y en ella concomitan la afectación sistémica con la toma neurológica o esta aparece en el transcurso de la progresión de la enfermedad.12,13
Los linfomas primarios del sistema nervioso central son entidades muy infrecuentes,14,15 representan el 1 % de todos los LNH extraganglionares. Su incidencia es de 4 casos por millón de personas anuales y puede alcanzar el 4 % de los tumores primarios del sistema nervioso central. Mientras que los secundarios se pueden presentar en un tercio de los pacientes con diagnóstico previo de LNH.16,17
Hasta un 90 % de los LPSNC no asociados con VIH, son linfomas difusos de células grandes B (LNH DCGB) y el 10 % restante puede comprender otras variedades (linfomas de Burkitt, linfomas de células T o linfomas de bajo grado pobremente diferenciados).18,19
El factor determinante para el desarrollo de la enfermedad es la inmunosupresión, bien sea congénita o adquirida, entre estas últimas se encuentran la inmunosupresión posterior al trasplante y la infección por VIH, entre cuyos pacientes la incidencia puede alcanzar hasta un 6 %.18 El riesgo también aumenta en pacientes con enfermedades autoinmunes como el lupus eritematoso sistémico, la sarcoidosis, la vasculitis y otros.20,21
Los linfomas primarios del sistema nervioso central tienen una rápida respuesta a los esteroides, al parecer por linfocitolisis directa, disminución del edema cerebral22 y alteración de la morfología celular, por lo que se evita en algunos casos antes de la biopsia cerebral requerida para el diagnóstico, pero recaen con rapidez, por lo que se necesitan otras estrategias terapéuticas como la quimioterapia23 y la radioterapia.24 Esta respuesta terapéutica también se ha propuesto como factor de buen pronóstico en pacientes sin infección por VIH.25
A pesar de los adelantos terapéuticos, los linfomas con afectación del SN, ya sean primarios o secundarios, muestran el peor pronóstico entre todos los LNH sobre todo en los pacientes con LDH elevada, IPI alto y estadios avanzados, con una supervivencia global a los 5 años que puede oscilar entre un 4 y un 40 % según algunos estudios.26
Por lo anteriormente planteado, y teniendo en cuenta la baja incidencia en general de este tipo de afectación en los casos con LNH, decidimos realizar este estudio para conocer mejor el comportamiento clínico-biológico y la respuesta terapéutica de dichos pacientes en nuestro medio.
MÉTODOS
Se realizó un estudio observacional descriptivo con datos retrospectivos registrados en las historias clínicas de los pacientes afectados del Servicio de Hematología del Hospital Clínico Quirúrgico "Hermanos Ameijeiras" desde el año 2000 hasta el año 2016. El universo estuvo constituido por todos los pacientes con diagnóstico de LNH con infiltración primaria o secundaria del SN, tanto al debut como en el curso de la enfermedad; atendidos en el Servicio de Hematología del Hospital Clínico Quirúrgico "Hermanos Ameijeiras" en el período antes mencionado.
La muestra quedó constituida por 26 pacientes, luego de cumplir con los siguientes criterios de inclusión: 18 años o más de edad, con diagnóstico histopatológico de LNH, con toma del SN primaria o secundaria, con o sin manifestaciones clínicas y de exclusión (casos VIH positivos, con datos incompletos a los efectos del presente estudio o con diagnóstico de otras enfermedades del sistema nervioso que justificaran el cuadro neurológico).
Las siguientes variables fueron evaluadas en todos los casos: Edad (agrupando los pacientes en 18-45, 46-59 y >60 años); sexo (masculino y femenino); color de la piel (blanca, negra, mestiza); diagnóstico histopatológico (según la clasificación de la OMS de las neoplasias linfoides);3 tipo de infiltración del SN (primaria o secundaria); localización de la afectación de los LPSNC; estadio clínico al diagnóstico (según los criterios de Ann Arbor modificados en Costwolds) y grupos pronóstico (según el IPI general).4,5
El tratamiento aplicado se definió como quimioterapia, radioterapia, altas dosis de metotrexate o cualquiera de sus combinaciones. La respuesta al mismo fue evaluada de la siguiente forma: remisión completa (RC)(desaparición de los síntomas y signos de la enfermedad sin que existan manifestaciones residuales del tumor); remisión parcial (RP) (dado por reducción de la masa tumoral en más del 50 % del tamaño inicial) y no respuesta (NR) (si al cuarto ciclo de tratamiento no se constata elemento alguno de respuesta favorable o se detecta la presencia de enfermedad en sitios no involucrados al diagnóstico o cuando solo se alcanza una reducción de la masa tumoral menor del 25 % del tamaño inicial).
Para analizar la sobrevida lograda se consideró como supervivencia libre de enfermedad (SLE) el período de tiempo transcurrido entre la fecha de la RC y la fecha de recaída o de la última consulta en RC y como supervivencia global (SG) el período de tiempo transcurrido entre la fecha del diagnóstico y la fecha del fallecimiento o de la última consulta registrada.
Los datos se obtuvieron de las historias clínicas confeccionadas en el Servicio de Hematología y se plasmaron en un modelo de recolección de datos. Se confeccionó una base de datos en Microsoft Office Excel 2010 para el almacenamiento y organización de la información. La información se procesó mediante el programa SPSS versión 20. Se utilizaron medidas de resumen para variables cualitativas (porcentajes) y en las cuantitativas la media y la desviación estándar. Para la estimación de la supervivencia global y libre de enfermedad se aplicó el método de Kaplan-Meier.
Durante toda la investigación se mantuvo la confidencialidad de la información recogida en las historias clínicas, procurando que en las bases de datos para análisis y procesamiento no se pudieran identificar a los pacientes individualmente. Esta información se utilizó solamente con fines investigativos, sin entrañar daño ni perjuicio para los pacientes y teniendo en cuenta los principios básicos de la ética médica.
RESULTADOS
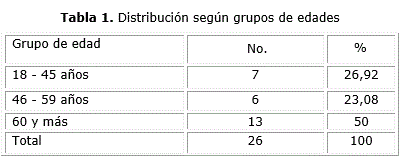
Se apreció que con relación a la edad, los casos más afectados resultaron los mayores de 60 años, (tabla 1) con un total de 13 pacientes (50,0 %).
Con relación al sexo, la incidencia fue mayor en el sexo masculino con un total de 15 pacientes para un 57,69 % (tabla 2).
El análisis sobre el color de la piel arrojó que predominaron los pacientes de piel blanca, con 21 casos (80,77 %) (tabla 3).
En la tabla 4 se muestra la distribución de los pacientes según tipos histopatológicos; siendo más frecuentes los subtipos agresivos de la enfermedad: el LNH DCGB con un total de 15 pacientes (57,69 %) y el Burkitt con 4 casos (15,38 %).
En la tabla 5 se muestra la distribución de los pacientes con infiltración primaria del SNC.
De los 14 casos con infiltración primaria del SNC, la localización más frecuente fue la leptomeníngea 8 casos (57,15 %), seguido de la infiltración cerebral con 5 casos (35,71 %). Con respecto a la infiltración secundaria la localización cerebral fue la más frecuente con 7 casos para un 26,92 % seguido de la afectación de pares craneales con 5 casos (19,23 %) (tabla 6).
En la tabla 7 se muestra la distribución de los pacientes por estadio clínico según los criterios de Ann Arbor, y observamos que el estadio I, 9 casos (64,29 %) fue el más frecuente en los 14 pacientes con infiltración primaria y en la secundaria el mayor por ciento de pacientes se incluyeron en el estadio IV, 8 casos (66,67 %).
En la tabla 8 se observa que predominaron los pacientes sin síntomas B (61,5 %). De los que presentaron estos síntomas, resultaron más frecuentes aquellos con afectación secundaria, 7 casos (58,33 %).
En la tabla 9 se aprecia la distribución de los pacientes según grupos de riesgo y observamos que de acuerdo a los parámetros del IPI existió un predominio de los pacientes en el grupo de riesgo alto intermedio con 13 pacientes (50 %) seguido del bajo-intermedio con 9 pacientes (34,61 %).
En la tabla 10 apreciamos que de los 26 pacientes, la RC se alcanzó en 7 casos (26,92 %), en 9 la RP (34,61 %) y NR en 10 pacientes (38,47 %) y al revisar la respuesta por esquemas impuestos tenemos que el mayor número de RC lo alcanzaron los pacientes tratados con metotrexate, que totalizaron 4 pacientes para un 15,38 %. Debe observarse que en los casos en los que se empleó quimioterapia más altas dosis de metotrexate se alcanzó una repuesta global (RC + RP) de 26,93 %, a expensas de las RP.
En la tabla 11 y en la figura 1 se aprecia que la SLE fue de aproximadamente el 60 % a los 2 años, con una disminución paulatina a los 4 años de menos del 40 % y a los 5 años del 18 %.
También observamos en la tabla 12 y en la figura 2 que mientras aumentó el período de observación, la probabilidad de SG disminuyó, siendo del 73 % y 23,5 % a los 2 y 5 años respectivamente.
DISCUSIÓN
Los linfomas no Hodgkin son un grupo de neoplasias de origen linfoide que pueden infiltrar el SN. Por su baja frecuencia, no existen estudios clínicos amplios sobre su comportamiento. En las últimas décadas se ha producido un crecimiento progresivo en su incidencia, debido al gradual aumento del número de pacientes inmunodeprimidos, así como al incremento de la expectativa de vida, ya que la incidencia del LPSNC se ha triplicado entre los individuos de la tercera edad.
En el presente estudio también predominaron los casos mayores de 60 años con un 50,0 %, lo que resulta similar a lo señalado con anterioridad por otros investigadores.9 Aunque Jiménez y otros reportaron en un estudio una edad promedio al momento del diagnóstico de 42,6 años,10 el resultado obtenido en la presente investigación es lo esperado para una enfermedad cuya incidencia es mayor en la tercera edad. Con relación al sexo, la mayor incidencia en el sexo masculino (57,69 %), se asemeja a lo reportado en varios estudios anteriores.10,11 La mayor frecuencia en pacientes de piel blanca de la muestra se corresponde con lo señalado en la literatura.9-11 Además, este resultado puede reflejar la distribución étnica de la población cubana, donde son más frecuentes los habitantes de origen caucásico.
En cuanto a la distribución de los pacientes según tipos histopatológicos (tabla 1) se comprobó franco predominio de los subtipos agresivos, coincidiendo con lo reportado anteriormente, donde la incidencia del LNH DCGB es hasta de un 91 %.16,17 Según el tipo de infiltración en el SN (primaria vs secundaria), se comprobó un predominio de la toma primaria (53,85 %), lo cual resulta superior a lo publicado por Vidal y otros27 (8 %), donde la afectación linfomatosa del SNC precede al diagnóstico de la enfermedad hematológica. No obstante, la incidencia aquí encontrada también puede estar influida por el escaso número de pacientes incluidos en este estudio.
De acuerdo a la localización de la afectación neurológica se comprobó una mayor frecuencia de la toma leptomeníngea (57,15 %) en los casos con infiltración primaria del SNC en tanto la afectación cerebral resultó la principal entre aquellos con afectación secundaria (19,23 %). Dicho dato se corresponde con lo descrito por Grimm en el 2008,13 que describe con mayor frecuencia la toma leptomeníngea, seguido de la cerebral y la ocular, siendo la espinal la menos frecuente (1 %). También dicho autor plantea la asociación de la localización cerebral o leptomeníngea en conjunto con la ocular, lo que no se evidenció en los pacientes aquí evaluados. En los casos de infiltración secundaria lo más frecuente es la afectación cerebral seguida de la lesión de pares craneales.
Los hallazgos encontrados en cuanto la distribución de los pacientes por estadio clínico (tabla 3), coinciden con lo planteado por otros investigadores, que correlacionan la mayor posibilidad de debutar en estadio I a los casos con infiltración primaria, mientras que los que presentan infiltración secundaria tienen mayor tendencia a debutar en estadios avanzados.7,9
La presencia o no de síntomas B fue otro de los aspectos analizados (tabla 4), con relación a los mismos predominaron los pacientes sin síntomas B (61,5 %) en los casos con afectación primaria, no ocurriendo así entre los que presentaron diseminación secundaria de la enfermedad al SN 7 casos (58,33 %). Lo cual es planteado en otros estudios, en los que se refieren al debut del LPSNC sin síntomas B en la mayoría de los casos, ocurriendo todo lo contrario en la afectación secundaria.19 Esto se puede deber también a que la afectación secundaria aparece al debut de una enfermedad extendida o concomita con la progresión de la enfermedad asociándose a mayor sintomatología.
De acuerdo al debut de la enfermedad según el IPI se apreció un predominio de los pacientes en el grupo de riesgo alto intermedio y bajo-intermedio con 9 pacientes. Varios estudios han descrito un aumento de riesgo de recidiva en el SNC asociado a factores como afectación extranodal (más de una localización), LDH elevada y un IPI alto. Todos estos factores en su conjunto condicionan un pronóstico más desfavorable en este tipo de pacientes.19 Según los resultados expuestos en la tabla 6, la RC se alcanzó en un 26,92 % de los casos y una RP en el 34,61 %. El mayor número de RC lo alcanzaron los pacientes tratados con metotrexate (MTX) así como aquellos en los que se combinó quimioterapia más altas dosis de MTX (repuesta global de 26,93 %).
En general todo ello es semejante a lo señalado en otros estudios publicados, que consideran como tratamiento de elección las altas dosis de Metotrexate y plantean la pobre respuesta obtenida con radioterapia.8,20-28
En un reciente estudio multicéntrico en el que analizan a 551 pacientes con LPSNC de pacientes inmunocompetentes, fueron aleatorizados en 2 grupos, en el primer grupo fueron tratados con altas dosis de MTX y radioterapia y el otro grupo empleo altas dosis de MTX. Observaron que los pacientes tratados con radioterapia desarrollarían más toxicidad pero entre ambos grupos no hay una diferencia significativa en cuanto a intervalo libre de enfermedad y supervivencia.20 La radioterapia como tratamiento único es pocas veces curativa y cuando se ha empleado la supervivencia media ha oscilado entre 10 y 18 meses. Sin embargo, sí puede estar indicada en casos de tratamiento paliativos.29
En cuanto a la SLE alcanzada, esta resultó de solo un 18 % a los 5 años. En varios estudios previos se plantean remisiones cortas y las relacionan con el estadio y el tipo de tratamiento (en ocasiones paliativo por la avanzada edad del paciente y las comorbilidades presentes). 29 La pobre SLE obtenida también traduce la naturaleza agresiva del tumor en muchos casos (de alto grado de malignidad), la escasa efectividad de los tratamientos empleados y la dificultad que impone el hecho de tener que emplear drogas que penetren el SNC.
También observamos (tabla 7) que la SG también fue baja a los 5 años de seguimiento (23,5 %). En otros reportes se corrobora esta disminución de la supervivencia global con el transcurso de los años.10,29 Jiménez, en su estudio de solo 12 pacientes, plantea una sobrevida a los 5 años de hasta un 40 %, muy superior a lo obtenido en esta investigación, pero empleando una muestra considerablemente menor.14-31
Como se puede apreciar, y a pesar de representar una muestra pequeña, esta investigación confirma los elementos principales que caracterizan a los LNH que afectan el SN: Están conformados por casos con edades superiores a los 60 años, de histologías agresivas en su mayor parte; donde la toma primaria resultó más frecuente que la secundaria, predominando en esta última los casos en estadios avanzados y con síntomas B y siendo más frecuente la existencia de un IPI intermedio-alto. Las respuestas terapéuticas conseguidas resultaron pobres independientemente del esquema empleado y con una escasa SLE y SG a los 5 años.
Todos estos factores obligan a repensar la estrategia terapéutica a desarrollar en el futuro en este tipo de enfermedad, por lo desalentador que continúa siendo su pronóstico en la actualidad.
Conflicto de intereses
Los autores declaran que no existen conflictos de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Harris NL, Jaffe ES, Stein H, Banks PM, Chan JK, Cleary ML, et al. A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood. 1994;84:1361-92.
2. Jemal A, Siegel R, Xu J, Ward E. Cancer statistics, 2010. CA Cancer J Clin. 2010 [cited 2009 Jul 10];60:277-300. Available from: PubMed: PMID: 20610543.
3. Swerdlow SH, Campo E, Pileri SA, Harris NL, Stein H, Siebert R, et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms. Blood. 2016;127(20):22-9.
4. National Cancer Institute sponsored study of classifications of non-Hodgkin's lymphomas: summary and description of a Working formulation for clinical usage. The non-Hodgkin's Lymphoma pathologic classification project. Cancer. 1982;49:2112-35.
5. Lister TA, Crowther D, Sutcliffe SB. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin's disease: cotswolds meeting. J Clin Oncol. 2013;7:1630-36.
6. Anuario Estadístico de Salud. La Habana: MINSAP; 2014.
7. Bhagavathi S, Wilson JD. Primary central nervous system lymphoma. Arch Pathol Lab Med. 2008;132:1830-4.
8. A predictive model for aggressive non-Hodgkin's lymphoma. The international Non-Hodgkin's Lymphoma prognostic factors project. N Engl J Med. 1993;329:987-94.
9. Gelabert González M, Castro Bouzas D, Serramito García R, Frieiro Dantas C, Aran Echabe E. linfomas primarios del sistema nervioso central. Neurología. 2013 [citado 10 Jun 2009];28(5). Disponible en:http://www.elsevier.es/es-revista-neurologia-295-articulo-linfomas-primarios-del-sistema-nervioso-S0213485312001132
10. Jiménez Arango JA, Martínez López S, Gómez Escobar JP, Uribe Uribe CS, Arango Viana JC. Linfoma primario del sistema nervioso central: serie de casos. Acta Neurol Colomb. 2012 [citado 10 Ene 20011];28(1). Disponible en: http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S0120-87482012000100004&lng=en
11. Schabet M. Epidemiology of primary CNS lym-phoma. J Neuro Oncol. 1999;43:199-201.
12. Oken MM. Eastern Cooperative Oncology Group (ECOG, Zubrod, WHO) performance scale. Am J Clin Oncol. 1982;5:649-55.
13. Grimm SA, McCannel CA, Omuro AM, Ferreri AJ, Blay JY, Neuwelt EA, et al. Pri-mary CNS lymphoma with intraocular involvement: international PCNSL collaborative group report. Neurology. 2008;71:1355-60.
14. Ankina MA, Zavitaeva TA, Panferova TA, Shakhtarina SV, Pavlov VV. Cytogenetic study of bone marrow and blood cells in patients with non-Hodgkin lymphoma before and after antitumor therapy. Bull Exp Biol Med. 2007;143:236-9.
15. Freedman AS, Aster JC. Epidemiology, clinical manifestations, pathologic features, and diagnosis of diffuse large B cell lymphoma. UpToDate. 2013 [cited 2012 Jan 10]. Available from: http://www.uptodate.com/contents/epidemiology-clinical-manifestations- pathologic-features-and-diagnosis-of-diffuse-large-b-cell-lymphoma
16. Jaffe ES, Swerdlow SH, Campo E, Harris NL, Pileri SA, Stein H, editors, et al. Introduction and overview of classification of the lymphoid neoplasms. En: World Health Organitation classification of tumours of haematopoietic and lymphoid tissues. 4th ed. Lyon: IARC; 2013. p. 158-66.
17. Adamson P, Bray F, Costantini AS, Tao MH, Weiderpass E, Roman E. Time trends in the registration of Hodgkin and non-Hodgkin lymphomas in Europe. Eur J Cancer. 2007;43:391-401.
18. Ruiz Bilbao S, Hernandez A, Gómez Sánchez S, Romeu J, Llobera L, Carrato C, et al. Linfoma no-Hodgkin primario del sistema nervioso central asociado a sida en un paciente con panuveítis por virus Epstein-Barr. Reporte clínico- patológico [abstract]. Arch Soc Esp Oftalmol. 2015 [cited 2011 Jan 10];90(5). Available from: http://www.elsevier.es/en-revista-archivos-sociedad-espanola-oftalmologia-296-resumen-aids-rel
19. Ge Zhao MC, Chamberlain SP, Khot AS, Orlerud JE, Shinohara MM. Central nervous system involvement in cutaneous T-cell lymphoma: 2 lllustrative cases and review of current literature. In: Clinical lymphoma myeloma and leukemia. Amsterdam: Elsevier; 2014. p. 25-30.
20. Zhang D, Hu LB, Henning TD, Ravarani EM, Zou LG, Feng XY, et al. MRI findings ofprimary CNS lymphoma in 26 immunocompetent patients. Korean J Radiol. 2010;11:269-77.
21. Moir S, Fauci AS. B cells in HIV infection and disease. Nat Rev Immunol. 2009;9:235.
22. Mathew BS, Carson KA, Grossman SA. Ini-tial response to glucocorticoids. Cancer. 2006;106:383-7.
23. Ferreri AJ, Reni M, Foppoli M, Mar Tellim M, Pangalis GA, Frezzato M, et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet. 2009;374:1512-20.
24. Greer JP, Reddy NM, Williams.ME. Non-Hodgkin Lymphoma in adults. In: Greer, JP: editor. Wintrobe's clinical hematology. 13th ed. Philadelphia: Lippincott Williams & Wilkins; 2014. p. 1827-72.
25. Papayannopoulou Th, Abkowitz J, D'Andrea A, Migliaccio AR. Biology of erythropoiesis, erythroid differentiation and maturation. In: Hoffman R, Benz EJ, Shattil SJ, Furie B, Cohen HJ, Silberstein LE, et al. editors. Hematology: basic principles and practice. 4th ed. Philadelphia: Elsevier; 2005. p. 267-88.
26. Villano JL, Koshy M, Shaikh H. Age, genter, and racial difference and survival in primary CNS lymphoma. Br J Cancer 2011;105 :1414.
27. Vidal Serrano S, Gomez Carceles S, Sanz Fernández G, Pascagaza A, Martín Chacon E, Estefania Morales R. Metástasis en el sistema nervioso central de linfomas sistémicos. 2012 [citado 15 Oct 2018]. Disponible en: https://posterng.netkey.at/esr/viewing/index.php?module=viewing_poster&task=viewsection&ti=356214
29. Smlth JR, Braziel RM, Paoletti S, Lipp M, Uguccioni M, Rosenbaum JT. Expres-sion of B-cell-attracting chemokine 1 (CXCL13) by malignant lymphocytes and vascular endothelium in primary central nervous system lymphoma. Blood. 2003;101:815-21.
30. A predictive model for aggressive non-Hodgkin's lymphoma. The international Non-Hodgkin's Lymphoma prognostic factors project. N Engl J Med. 1993;329:987-94.
31. Jiang L, Marlow LA, Cooper SJ, Roemeling CV, Menke DM, Copland JA, et al. Selec-tive central nervous system tropism of primary central nervous system lymphoma. Int J Clin Exp Pathol. 2010;3:763-7.
Recibido: 12/01/2018.
Aprobado: 29/03/2018.
Calixto Hernández
Cruz. Hopital Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
Correo electrónico:
calixtohdez@infomed.sld.cu