ARTÍCULO ORIGINAL
Características clínicas y patológicas de pacientes cubanos con tumores del estroma gastrointestinal en etapas no metastásicas
Clinical and pathological characteristics of Cuban patients with gastrointestinal stromal tumors in non-metastatic stages
Vilma Fleites Calvo, Jorge L. Soriano García, Mayté Lima Pérez, Dunia Morales Morgado, Noyde Batista Albuerne, Iván Ramón Concepción, Carlos Domínguez Álvarez, Llipsy Fernández Santiesteban
Servicio de Oncología Clínica. Hospital "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción:
Los tumores del estroma gastrointestinal son neoplasias mesenquimales raras,
representando el 0,2 % de todos los tumores gastrointestinales.
Objetivo:
Caracterizar desde el punto de vista clínico y anatomopatológico a
los pacientes con tumores del estroma gastrointestinal en etapas no metastásicas.
Métodos:
Estudio longitudinal y retrospectivo con 144 pacientes con diagnóstico
de tumores del estroma gastrointestinal primario y localizados al debut, que
fueron operados inicialmente y atendidos en el Hospital Hermanos Ameijeiras,
entre junio 2003 y diciembre 2016.
Resultados:
La edad promedio fue 57 años. Predominaron los pacientes masculinos, y
el dolor abdominal como principal forma de presentación, mientras que la
localización más frecuente fue el estómago, seguida del intestino
delgado, y la media del tamaño tumoral fue de 10,3 cm. Más del 75
% de los pacientes presentaron tumores mayores de 5 cm, más del 60 % de
los pacientes tenían índice mitótico ≤ 5, y 80 % presentaba
un riesgo intermedio o alto (criterios de Fletcher). La forma de presentación
más frecuente fue el sangramiento en los tumores de colon/recto (50,0 %)
y estómago (48,6 %), mientras que el dolor abdominal lo fue para los tumores
del estroma gastrointestinal de intestino delgado (47,5 %) y peritoneo (85,7
%). Se logró la resección quirúrgica completa en el 90 % de los
casos. Nueve pacientes experimentaron progresión de la enfermedad. Catorce
pacientes desarrollaron metástasis después de la cirugía (9,7
%), y la localización más frecuente fue el hígado (92,8 %).
Conclusiones:
Este trabajo constituye el primer informe epidemiológico sobre tumores
del estroma gastrointestinal en Cuba, que brinda una pormenorizada información
del comportamiento de esta enfermedad en el llamado "mundo real", a partir de
una experiencia de protocolización centralizada.
Palabras clave: GIST; etapas no metastásicas; clínica.
ABSTRACT
Introduction
: Gastrointestinal stromal tumors are rare mesenchymal neoplasms, accounting
for 0.2 % of all gastrointestinal tumors.
Objective
: To characterize patients with Gastrointestinal stromal tumors in non-metastatic
stages from the clinical and anatomopathological point of view.
Methods :
Longitudinal and retrospective study, with 144 patients diagnosed with primary
and located gastrointestinal stromal tumors, who were initially surgically intervented,
and attended at the Hermanos Ameijeiras Hospital, between June 2003 and December
2016.
Results :
The average age was 57 years. Male patients predominated, and abdominal pain,
as the main form of presentation, while the most frequent location was the stomach,
followed by the small intestine, and the mean tumor size was 10.3 cm. More than
75 % of patients had tumors larger than 5 cm, and more than 60 % of patients
had a mitotic index ≤5, and 80 % had an intermediate or high risk (Fletcher
criteria). The most frequent form of presentation was bleeding in colon/rectum
tumors (50.0 %) and stomach (48.6 %), while abdominal pain was for the gastrointestinal
stromal tumors of small intestine (47.5 %) and peritoneum (85.7 %). Complete
surgical resection was achieved in 90 % of the cases. Nine patients, experienced
progression of the disease. Fourteen patients developed metastases after surgery
(9.7 %), and the most frequent location was the liver (92.8 %).
Conclusions
: This is the first epidemiological report on gastrointestinal stromal
tumors in Cuba, which provides a detailed information on the behavior of this
disease in the so-called "real world", based on a centralized protocolization
experience.
Keywords: GIST; non-metastatic stages; clinical.
INTRODUCCIÓN
A pesar que los tumores del estroma gastrointestinal (GIST, por sus siglas en inglés) son tumores raros, y representan el 0,2 % de todos los tumores que se presentan en el tracto gastrointestinal, constituyen el tipo de tumor mesenquimatoso más frecuente en dicho tracto.1 Se piensa que se originan a partir de las células intersticiales de Cajal (CIC) o de células madres progenitoras comunes.2-4
Los GIST son ligeramente más frecuentes en el sexo masculino, y aunque se han reportado en individuos de todas las edades, muchos de estos pacientes se encuentran entre los 40 y 80 años al momento del diagnóstico, con una mediana de edad de 60 años.5-7
Los GIST pueden presentarse en cualquier parte del tracto digestivo, pero los sitios más comunes son el estómago (60-65 %), y el intestino delgado (25-32 %). Cerca de 5-10 % de los GIST se localizan en el colon/ recto, y de un 0,7-5 %, en el esófago. Rara vez los GIST se desarrollan en el peritoneo, en el mesenterio o en el retroperitoneo, y se han descrito casos muy aislados con tumores en páncreas, y apéndice cecal.6
La cirugía es el tratamiento de elección para los GIST primarios, es la única estrategia terapéutica que puede ofrecer una cura permanente del tumor. La resección completa evitando la ruptura, y daño de la pseudocápsula tumoral es el tratamiento inicial para el GIST primario localizado, cuando el riesgo de mortalidad y morbilidad como consecuencia de la cirugía son aceptables. El objetivo de la cirugía es la resección completa del tumor con márgenes macroscópicos y microscópicos negativos, y la preservación de la funcionalidad cuando sea aplicable. La cirugía permite, además, el estadiamiento intraoperatorio, de manera de excluir las metástasis. Cómo debe ser el manejo en los casos de márgenes macroscópicos negativos y microscópicos positivos, no está bien definido y las opciones pueden incluir la re-intervención, el seguimiento cuidadoso expectante, y la terapia adyuvante.8-10
Se señala que la resección completa del tumor es posible en aproximadamente el 85 % de los pacientes con tumores primarios localizados, y los márgenes microscópicos negativos pueden lograrse en el 70-95 % de todos los casos en los que se realiza una resección completa.8
El Hospital Clínico-Quirúrgico "Hermanos Ameijeiras" (HCQHA) concentra la atención de pacientes con GIST del país, y es centro de referencia para el manejo de estos tumores desde el año 2003. De ahí que se realice este estudio con el objetivo de caracterizar la evolución clínica, la respuesta al tratamiento y la supervivencia global, en pacientes con tumores del estroma gastrointestinal localizados, y en los cuales se realizó una intervención quirúrgica inicial.
MÉTODOS
Se realizó un estudio longitudinal y retrospectivo en 144 pacientes con diagnóstico de GIST operados en el Hospital Hermanos Ameijeiras entre junio 2003 y diciembre 2016. Las fuentes de información fueron las planillas de tratamiento, historias clínicas, resultados de exámenes diagnósticos, e informes operatorios de cada paciente con diagnóstico de GIST, incluidos en la base de datos global de GIST del Servicio de Oncología Clínica.
Fueron incluidos en el estudio los pacientes con diagnóstico clínico y anatomopatológico de GIST, este último realizado por un mismo patólogo entrenado y especializado en esta enfermedad, y en la interpretación de la inmunohistoquímica relacionada con el mismo y en los cuales la cirugía constituyó la primera línea de tratamiento. Se excluyeron los pacientes que recibieron otro tipo de tratamiento ya fuera por neoadyuvancia o presentar metástasis al debut.
Se consideró que el tumor era potencialmente resecable cuando se tuvo un tumor localizado que podía ser extirpado quirúrgicamente en su totalidad sin comprometer estructuras u órganos vitales que afectaran la vida del paciente.
La progresión estuvo dada por el aumento de al menos un 20 % de la suma de las lesiones dianas o la aparición de una o más lesiones nuevas o la no disminución de la densidad en los nódulos tumorales preexistentes [ur J Cancer. 2009;45(2):228-47].
Fueron realizados los estudios de extensión, estadiamiento y de confirmación diagnóstica acorde a la Guía de Práctica Clínica de GIST, aprobada en el hospital.11 Se realizó examen clínico, exámenes hematológicos y hemoquímicos. Se realizó ecografía (US) abdominal/pélvica, y tomografía axial computarizada (TAC) abdominal y pélvica (simple y contrastada) en todos los pacientes. Se realizó ecografía endoscópica en el caso de tumores de esófago, estómago, y recto. La resonancia magnética nuclear (RMN) se empleó siempre en el caso de tumores de recto, y en el resto de las localizaciones fue opcional. Se realizó Rx de esófago, estómago y duodeno y endoscopia gástrica en las localizaciones accesibles. En todos los casos se realizó Rx de tórax y se indicó la TAC de tórax, en caso de imágenes sospechosas en el Rx. En todos los casos se realizó la confirmación histológica mediante biopsia. Se determinó el tamaño tumoral, la localización y el índice mitótico. Se realizó siempre la inmunohistoquímica para la detección de CD117, así como DOG-1. Se estudió además la presencia de CD34 y Ki 67.
El presente estudio contó con la aprobación del Consejo Científico del Hospital Clínico Quirúrgico "Hermanos Ameijeiras", quienes revisaron la calidad del proyecto y el adecuado cumplimiento de los procedimientos éticos. La investigación se diseñó y ejecutó según los principios éticos para la investigación médica con sujetos humanos. Los procederes terapéuticos de tipo farmacológico o quirúrgicos aplicados a los pacientes les fueron explicados inicialmente, o cuando hubo que realizar algún cambio en la terapéutica, y forman parte del Protocolo de Actuación Asistencial de atención a esta enfermedad, contenido en el Manual de Prácticas Médicas del hospital, con el consiguiente consentimiento informado asistencial. De ahí que no fuera necesario solicitar un consentimiento informado al paciente específicamente para esta investigación.
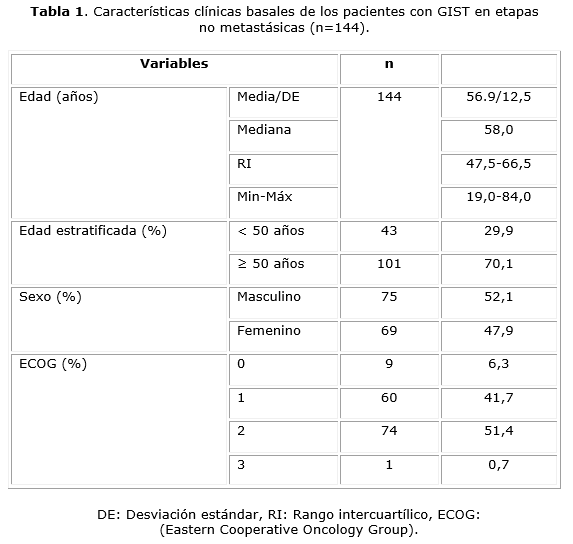
RESULTADOS
En la tabla 1 se analizan las características clínicas basales de los pacientes. La media de edad fue 56,9 años y más del 70 % de los pacientes tenía 50 años o más. Predominaron los pacientes del sexo masculino y con ECOG 2.
Cuando se analizaron las características de los pacientes relacionados con el tumor (tabla 2), se observó que la forma de presentación más frecuente fue el dolor abdominal, seguido del sangrado digestivo alto. Por su parte, la localización más frecuente fue la gástrica, seguida del intestino delgado, y la media del tamaño tumoral fue de 10,3 cm. Más del 75 % de los pacientes presentaron tumores mayores de 5 cm. En más del 60 % de los pacientes, el índice mitótico fue de 5x50CGA o menos, y cuando se evaluó el riesgo mediante los criterios de Fletcher, más del 80 % presentaba un riesgo intermedio o alto. De los 144 pacientes, solo 2 fueron negativos para el marcador CD117. La mediana de positividad del marcaje de Ki-67 fue 5,5 %, y en más del 65 % de los pacientes, el porcentaje de positividad era menor o igual a un 10 %.
Tabla
2. Características de los pacientes
con GIST en etapas no metastásicas, relacionadas
con el tumor (n=144).
|
Variables |
n |
||
|
Forma de presentación (%) |
Dolor abdominal |
48 |
33.3 |
|
Sangrado digestivo alto |
44 |
30.6 |
|
|
Masa abdominal palpable |
29 |
20.1 |
|
|
Anemia severa |
20 |
13.9 |
|
|
Rectorragia |
3 |
2.1 |
|
|
Localización tumoral primaria (%) |
Gástrico |
70 |
48.6 |
|
Intestino delgado |
61 |
42.4 |
|
|
Colon/Recto |
6 |
4.2 |
|
|
Retroperitoneo |
7 |
4.9 |
|
|
Tamaño tumoral (cm) |
Media/DE |
144 |
10.3/5.6 |
|
Mediana |
9.0 |
||
|
RI |
6.0-14.0 |
||
|
Min-Máx |
0.4-30.0 |
||
|
Tamaño tumoral estratificado (%) |
≤2cm |
1 |
0.7 |
|
> 2cm ≤ 5cm |
31 |
21.5 |
|
|
> 5 cm ≤10 cm |
59 |
41.0 |
|
|
> 10 cm |
53 |
36.8 |
|
|
Índice mitótico (%) |
≤ 5 mitosis/50 CGA |
89 |
61.8 |
|
> 5 mitosis/50 CGA |
55 |
38.2 |
|
|
Criterios de Fletcher (%) |
Bajo riesgo |
24 |
16.7 |
|
Riesgo intermedio |
67 |
46.5 |
|
|
Alto riesgo |
33 |
36.8 |
|
|
CD117 (%) |
Negativo |
2 |
1.4 |
|
Positivo |
142 |
98.6 |
|
|
CD34 (%) |
Negativo |
45 |
31.3 |
|
Positivo |
99 |
68.8 |
|
|
Ki 67 (% de positividad) |
Mediana |
144 |
5.5 |
|
RI |
3.0-20.0 |
||
|
Min-Max |
1.0-80.0 |
||
|
Ki 67 estratificado (%) |
≤ 10% |
96 |
66.7 |
|
> 10% |
48 |
33.3 |
|
La tabla 3 muestra el comportamiento de las variables clínicas y anatomopatológias según sitio primario de localización tumoral. Los GIST localizados en Colon/Recto tuvieron una media de edad de 52,7 años mientras que en los de localización gástrica fue de 59,8 años. Predominó el sexo masculino en todas las localizaciones excepto en los tumores gástricos. No existieron diferencias entre las diferentes localizaciones tumorales en cuanto al tamaño, índice mitótico, Ki 67, ECOG y Criterios de Fletcher, predominando los tumores mayores de 5 cm, con índice mitótico menor de 5 x50CGA, Ki 67 menor del 10 %, ECOG 1-2 y riesgo intermedio o alto según los Criterios de Fletcher. La forma de presentación más frecuente fue el sangramiento en los tumores de Colon/Recto (50,0 %) y Estómago (48,6 %), mientras que el dolor abdominal lo fue para los GIST de intestino delgado (47,5 %) y peritoneo (85,7 %). En todas las localizaciones predominaron los márgenes limpios luego de la cirugía. El intestino delgado fue la localización en que más se reportaron márgenes comprometidos, igualmente fue el sitio donde más ruptura tumoral se presentó.
Tabla 3. Comportamiento
de las variables clínicas y anatomopatológicas según sitio primario de localización
tumoral, en pacientes con GIST en etapas no metastásicas
(n=144).
|
Variables |
Colon/Recto |
Intestino Delgado |
Estómago |
Peritoneo |
x² |
|
|
Edad |
Media |
52.7 |
54.5 |
59.8 |
53.1 |
|
|
Mediana |
56.00 |
55.00 |
60.50 |
58.00 |
||
|
Min-Máx |
33-64 |
19-84 |
30-79 |
36-70 |
||
|
Sexo |
Masculino |
6 (100%) |
33(54.1%) |
31(44.3%) |
5(71.4%) |
|
|
Femenino |
0 (0%) |
28 (45.9%) |
39(55.7%) |
2(28.6%) |
0.039 |
|
|
Tamaño Tumoral |
< 5cm |
1(16.7%) |
11(18.0%) |
19(27.1%) |
1(14.3%) |
|
|
5-10cm |
3(50.0%) |
21(34.4%) |
33(47.1%) |
2(28.6%) |
0.443 |
|
|
> 10cm |
2(33.3%) |
29(47.5%) |
18(25.7%) |
4(57.1%) |
||
|
Mitosis |
≤ 5 mitosis/50 CGA |
4(66.7%) |
35(57.4%) |
45(64.3%) |
5(71.4%) |
|
|
> 5 mitosis/50 CGA |
2(33.3%) |
26(42.6%) |
25(35.7%) |
2(28.6%) |
0.795 |
|
|
Ki 67 |
<10% |
1(16.7%) |
31(50.8%) |
45(64.3%) |
2(28.6%) |
|
|
10-19% |
1(16.7%) |
11(18.0%) |
13(18.6%) |
0(0%) |
0.279 |
|
|
≥20% |
4(66.7%) |
19(31.2%) |
12(17.1%) |
5(71.4%) |
||
|
ECOG |
0 |
0(0%) |
5(8.2%) |
4(5.7%) |
0(0%) |
|
|
1 |
4(66.7%) |
20(32.8%) |
33(47.1%) |
3(42.9) |
||
|
2 |
2(33.3%) |
35(57.4%) |
33(47.1%) |
4(57.1%) |
0.716 |
|
|
3 |
0(0%) |
1(1.6%) |
0(0%) |
0(0%) |
||
|
Clasificación Fletcher |
Bajo Riesgo |
0(0%) |
9(14.8%) |
14(20.0%) |
1(14.3%) |
|
|
Intermedio |
4(66.7%) |
23(37.7%) |
38(54.3%) |
2(28.6%) |
||
|
Riesgo |
0.142 |
|||||
|
Alto Riesgo |
2(33.3%) |
29(47.5%) |
18(25.7%) |
4(57.1%) |
||
|
Forma de Presentación |
Anemia Severa |
1(16.7%) |
5(8.2%) |
14(20.0%) |
0(0%) |
|
|
Dolor Abdominal |
2(33.3%) |
29(47.5%) |
11(15.7%) |
6(85.7%) |
||
|
0.000 |
||||||
|
Masa Palpable |
0(0%) |
17(27.9%) |
11(15.7%) |
1(14.3%) |
||
|
Sangramiento |
3(50.0%) |
10(16.4%) |
34(48.6%) |
0(0%) |
||
|
Márgenes Limpios |
Si |
5(83.3%) |
51(83.6%) |
69(98.6%) |
5(71.4%) |
|
|
0.008 |
||||||
|
1(16.7%) |
10(16.4%) |
1(1.4%) |
2(28.6%) |
|||
|
No |
||||||
|
Ruptura Tumoral |
Si |
1(16.7%) |
10(16.4%) |
1(1.4%) |
2(28.6%) |
|
|
0.002 |
||||||
|
No |
5(83.3%) |
51(83.6%) |
69(98.6%) |
5(71.4%) |
||
La tabla 4 resume un grupo de características de los pacientes con GIST en etapas no metastásicas tratados inicialmente con cirugía, después de ser intervenidos. La resección completa del tumor se logró en el 90,3 %, y se produjo ruptura de la pseudo-cápsula del tumor en solo seis pacientes (4,2 %). El 59,9 % fue tratado con Imatinib después de la cirugía. En la gran mayoría de los casos se administraron 400 mg del fármaco (91,1 %). De los 130 pacientes, en los cuales se logró una resección completa del tumor, 22 tuvieron una primera recaída (16,9 %) y 5 una segunda recaída (3,8 %). Nueve pacientes, en los cuales no se logró la resección completa del tumor, experimentaron progresión de la enfermedad. Catorce pacientes desarrollaron metástasis después de la cirugía (9,7 %), y la localización más frecuente fue el hígado (92,8 %). Cinco pacientes presentaron metástasis en más de un sitio (35,7 %) y en todos los casos se trató de la combinación hígado más peritoneo.
DISCUSIÓN
Como ya se ha señalado previamente, los GIST son los tumores mesenquimatosos más frecuentes del tracto gastrointestinal. En el presente estudio, el 70,1 % de estos pacientes tenía 50 años o más, con una media alrededor de los 56,9 años, y un ligero predominio de pacientes del sexo masculino. Lo que se corresponde con lo reportado, porque si bien se trata de tumores que pueden presentarse en cualquier edad, cerca de las tres cuartas partes de los GIST son diagnosticados en pacientes por encima de los 50 años, con una mediana de 58 años,5 igual a la obtenida en el presente estudio. En series basadas en población que incluyen casos de necropsia, se observan medianas de edad 10 años mayores (56,3-69,0 años). 7 Aunque en muchos de los estudios publicados no es evidente el predominio por un sexo en cuestión,12,13 algunos revelan que existe una ligera predilección por el sexo masculino en una relación 1,1-1,6/1.14-16
Sapalidis y cols .17 en un análisis de 18 casos con GIST reporta una razón hombre/mujer de 1.57: 1 (11 hombres/ 7 mujeres). En el estudio realizado por Arolfo y cols.18 que relata la experiencia de 13 años del San Luigi Teaching Hospital (Turín), ellos analizan 32 pacientes operados de GIST. Reportan una media de edad de 63,7 años (rango: 40-90 años), y un ligero predominio de hombres (56,0 %). En el estudio de Wang y cols.19 que también describe la experiencia de 15 años de un centro ( Ren Ji Hospital, School of Medicine, Shanghai JiaoTong University), y en el cual se estudiaron 497 pacientes con GIST operables, reportan una mediana de edad de 60 años (rango: 23-90) y 55,9 % fueron hombres. Borunda y cols.20 estudian 71 pacientes con enfermedad no resecable, metastásica o recurrente, en un hospital de tercer nivel en México, y reportan una mediana de edad de 59 años y un predominio de pacientes femeninas (59,2 %).
Más del 93 % de los pacientes en el presente estudio presentaba un ECOG1/2, lo cual es lógico esperar al tratarse de un estudio basado en un hospital, y que en todos los casos se trató de pacientes sintomáticos, incluso remitidos de otros centros hospitalarios.
La forma de presentación más frecuente en la serie de casos analizada fue el dolor abdominal; mientras que las localizaciones más frecuentes fueron estómago, en primer lugar, e intestino delgado en segundo. Søreide y cols.7 en su revisión sistemática señala que el 81,3 % de los pacientes son sintomáticos y citan el dolor abdominal como uno de los síntomas de presentación más frecuentes. Por otra parte, estos autores también señalan que el estómago y el intestino delgado son las localizaciones más frecuentes de estos tumores. De los 18 pacientes estudiados por Sapalidis y cols.,17 diez presentaban dolores abdominales inespecíficos como principal síntoma, y en 11, el tumor se encontraba localizado en estómago. De los 497 pacientes estudiados por Wang y cols.,19 el 37,0 % se quejaban de dolores abdominales; en el 59,0 % (293 pacientes) el tumor primario se situaba en estómago, y en el 22,5 % (112 pacientes) en intestino delgado. En el estudio realizado por Arolfo y cols. 18 la forma de presentación más frecuente fue el sangrado gastrointestinal agudo o la anemia crónica (50 %, 16 pacientes), seguido del dolor abdominal inespecífico (37,5 %, 12 pacientes) y la mayoría de los tumores se localizaban en estómago (56,3 %). Por su parte, Borunda y cols.20 muestran que el síntoma más frecuente fue el dolor, presente en 29 pacientes y la localización predominante, fue también en este caso, el estómago.
La presentación clínica de estos tumores es extremadamente heterogénea y los síntomas son por lo general inespecíficos, lo que, en gran medida, explica dificultades para el diagnóstico temprano de este tipo de tumores. Tómese en consideración que un porcentaje importante de ellos cursa de manera asintomática y son descubiertos de manera incidental o en las autopsias. Por otra parte, la sintomatología va estar relacionada con el tamaño tumoral y la localización del tumor, como ya se ha señalado.7
Si bien estos tumores pueden aparecer en cualquier localización a lo largo del tracto digestivo e incluso fuera de este (retroperitoneo, omento, mesenterio, por citar algunos ejemplos), es un aspecto bien confirmado, que las localizaciones más frecuentes de estos tumores son en primer lugar el estómago, y, en segundo lugar, el intestino delgado.17
Como se ha señalado, la sintomatología de estos tumores guarda relación con el tamaño tumoral, y según el estudio de Kindblom y cols.21 citado previamente, la mediana de los tumores sintomáticos era de 6 cm (rango: 1-35 cm). En el presente estudio, todos los tumores fueron sintomáticos al momento del diagnóstico y el 77,8 % de los tumores eran mayores de 5 cm.
Arolfo y cols.18 reportan una media de tamaño tumoral de 7 cm, y Wang y cols.19 reportan que la mayoría de sus pacientes tenían tumores entre 2.1 y 10 cm. Tanto el tamaño, como el rango son menores al que se agrupan la mayoría de los pacientes en el presente estudio. Según la revisión de tres trabajos realizada por Søreide y cols.,7 el 49 % de los tumores estudiados eran mayores de 5 cm y sólo un 13 % era menor de 2 cm. De forma general, las diferencias halladas entre los trabajos podrían estar determinadas en gran medida, por el momento en que se realizó el diagnóstico de estos tumores.
En el presente estudio, la mediana del porcentaje de positividad del Ki-67 fue de 5.5 %, aunque el 75 % de los pacientes se encontraba por debajo del 20 % y la mayoría tenía menos de un 10 % de manera general. El índice Ki-67 es uno de los más importantes marcadores inmunohistoquímicos de proliferación celular en tumores. 22-24 Carrillo y cols.22 han señalado que Ki-67 es uno de los más precisos predictores del comportamiento clínico de los GIST, aunque esto no ha sido confirmado siempre. Uno de los problemas más generalizados con este marcador es el valor del punto de corte empleado. Zhao y cols.,23 en su estudio acerca del valor pronóstico de este índice, parten del hecho que los criterios de este índice no están bien establecidos para los GIST, y evalúan el valor pronóstico del índice Ki-67 en 418 pacientes con GIST (370 pacientes sometidos solo a cirugía y 48 casos con alto riesgo, en los cuales se logró un R0). Para ello, utilizaron 2 puntos de corte (> 5 y > 8 %) y observaron que con el punto de corte >8 % podían dividir de manera precisa los GIST de alto riesgo con diferentes resultados.
Al evaluarse el comportamiento de las variables clínicas y anatomopatológicas, teniendo en cuenta la localización del sitio del tumor primario, encontramos en nuestro estudio que, con respecto a la edad, los tumores de colon/recto y peritoneo se presentaron más tempranamente con una media de 52,7 y 53,1 años, respectivamente, mientras que los tumores de intestino delgado y estómago se presentaron en edades más avanzadas con una media de 54,5 y 59,8 años, respectivamente. Solo en los tumores gástricos existió predominio del sexo femenino.
En el estudio de Giuliano y cols.,3 la media de edad para los tumores de presentación gástrica fue de 65 años, mientras que para los tumores de intestino delgado fue más baja, con una media de 62 años; estando por encima de lo reportado en nuestra serie, sin embargo, hubo coincidencias entre ambos estudios con respecto al sexo donde estos investigadores encontraron que el sexo femenino solo prevaleció en los tumores de estómago, y en el resto de las localizaciones tumorales existió un ligero predominio del sexo masculino.
Aproximadamente el 70 % de los pacientes con GIST presentan síntomas, entre los cuales los más frecuentes son: sangrado del tubo digestivo, obstrucción intestinal y dolor abdominal. Hasta un 20 % puede cursar asintomático o con síntomas sumamente inespecíficos. 1 En nuestro estudio el sangramiento fue la forma de presentación más frecuente en las localizaciones de colon/recto y estómago, mientras que el dolor abdominal predominó en los tumores de intestino delgado y peritoneo.
En el estudio realizado por Arolfo y cols.,18 la forma de presentación más frecuente fue el sangrado gastrointestinal agudo (50 %, 16 pacientes), y la mayoría de los tumores se localizaban en estómago (56,3 %). En la serie de pacientes estudiados por Wang y cols.,19 el 37,0 % se quejaban de dolores abdominales; en el 59,0 % el tumor primario se situaba en estómago, y en el 22,5 % en intestino delgado. En el estudio de Jiehua y cols., 13 el dolor abdominal y el sangramiento digestivo se presentaron en iguales porcientos (31,3 %), y en el 21,4 %, el diagnóstico fue incidental, encontrándose los pacientes asintomáticos. Estos investigadores13,19 reportan además el sangramiento como síntoma más frecuente de presentación en los tumores de colon/recto y el dolor en la localización peritoneal.
El tamaño tumoral es un factor pronóstico importante. En nuestra serie de casos, predominaron los tumores mayores de 5 cm, y el intestino delgado fue el sitio primario de localización donde se reportaron la mayoría de las lesiones mayores de 10 cm. Giuliano y cols. 3 y DeMatteo y cols.,5 presentan en sus series de casos que los sitios de mayor tamaño tumoral reportados son el intestino delgado y el retroperitoneo, donde estos tumores crecen ocasionando inicialmente pocos síntomas, y llegan a diagnosticarse con un crecimiento significativo, y lesiones mayores de 5 cm que producen síntomas al paciente, ya sea dolor, síntomas por compresión de otras estructuras, o una masa palpable. En el estómago, estos investigadores3,5 reportan mayormente tumores menores de 5 cm, y en los casos de diagnósticos incidentales durante endoscopia digestiva superior, han reportado tumores menores de 1 cm, lo cual generalmente se asocia a pacientes con ECOG 0.
La clasificación ECOG, independientemente de la localización tumoral primaria, predominó entre 1-2 en los pacientes de nuestro estudio. Las bibliografías consultadas coinciden en el hecho de que la mayoría de los pacientes con GIST al diagnóstico se encuentran muy sintomáticos. Se debe señalar que 5 pacientes con tumores de intestino delgado y 4 pacientes con tumores gástricos al debut presentaban ECOG 0, y esto coincide a su vez con que se trataban de tumores menores de 5 cm, lo cual puede justificar el hecho de que los pacientes se encontraran asintomáticos.
Como se mencionó anteriormente, existieron variables como el índice mitótico, Ki-67 y clasificación de Fletcher que independientemente de la localización tumoral primaria no mostraron variaciones, predominando así en cualquiera de las localizaciones los tumores con índice mitótico menor de 5x50CGA, Ki-67 en menos del 10 %, y los grupos de riesgo intermedio y alto según la clasificación de Fletcher.
Igualmente, en nuestro estudio, independiente de la localización tumoral primaria, predominaron los márgenes limpios luego de la cirugía y se reportaron pocos casos dentro de cada grupo donde existió ruptura del tumor. En nuestro estudio, la localización donde más existió compromiso de los márgenes quirúrgicos fue el intestino delgado. Estudios revisados avalan que el intestino delgado por su compleja anatomía, es un sitio propenso a la posibilidad de obtener márgenes positivos luego de la cirugía. Generalmente se sugieren cirugías radicales o en bloque, fundamentalmente si los tumores se localizan en la segunda porción duodenal o infiltran la ampolla de Vater.19
En los pacientes del estudio, en más del 90 % se logró una cirugía R0, con un porcentaje de ruptura inferior al 5 %. Arolfo y cols.18 en su estudio retrospectivo, en el que incorporaron 32 pacientes en diferentes estadios de la enfermedad, que fueron operados (ya referido previamente), reportaron que obtuvieron una radicalidad de la resección quirúrgica R0 en el 90,7 %, porcentaje muy similar al reportado en el presente trabajo, pero también reportaron que un caso presentó R2 (3,1 %), aspecto en el cual difiere del presente estudio donde no se reportaron pacientes con resecciones R2. Bejarano y cols.25 observaron que en 23 de los 30 pacientes lograron R0.
La cirugía es la única estrategia terapéutica que brinda la oportunidad de curación en pacientes con GIST primario y localizado. 25,26 Como se ha señalado, el objetivo de la operación es lograr una resección R0, y con la pseudo-cápsula intacta. Sin embargo, las posibilidades de obtener estos resultados están influenciadas por aspectos como el tamaño, la localización tumoral, la compresión de estructuras vecinas, y el compromiso funcional que acarrean, y, además, por el hecho que, si bien la toma ganglionar no es frecuente en estos pacientes, el tumor puede infiltrar estructuras vecinas. No está del todo claro el manejo más adecuado de los pacientes con una resección R1 ni del impacto en estos pacientes.
McCarter y cols. 26 estudiaron 819 pacientes con GIST, pertenecientes a 230 instituciones, incluidos en los ensayos clínicos ACOSOG Z9000, y Z9001, que fueron sometidos a cirugía. En ellos estudiaron una serie de características del paciente y del tumor que pudieran estar asociadas con una resección R1. En este estudio, el 8,8 % de los pacientes (72 pacientes) tuvo una resección R1 y los mismos fueron seguidos por un periodo de 49 meses. Hallaron que el tamaño tumoral (≥10 cm), localización (recto) y la ruptura tumoral se asociaban con la resección R1. Sin embargo, no encontraron diferencia en cuanto a la tasa de supervivencia libre de recaída (SLR), entre los pacientes que presentaron una resección R1 y una R0 (HR=1,095, IC-95 %: 0,66, 1,82, p=0,73) o entre los pacientes que recibieron adyuvancia con Imatinib y aquellos que no la recibieron (HR=1,51, IC-95 %: 0,76, 2,99, p=0,24), independientemente del tipo de resección (R0 vs. R1).
Estos investigadores26 encontraron, además, que el riesgo de recurrencia de la enfermedad estaba ampliamente afectado por la presencia de ruptura tumoral. Se conoce que los GIST son tumores friables y muy vascularizados, y que la ruptura tumoral es un factor pronóstico muy desfavorable incluido por Joensuu y cols.27 y Takahito y cols.28 como uno de los criterios de alto riesgo de recaídas.
Por otra parte, en un meta-análisis realizado por Zhi y cols. 29 concluyeron que la presencia de márgenes microscópicamente positivos podría tener un impacto significativo en la supervivencia libre de enfermedad (SLE) (HR: 1,596, IC-95 %:1,128-2,258; I2: 37,5 %, p=0,091) (se insiste en el término, pues la p es >0.05), pero no lo tenía en la supervivencia global (SG) (HR: 1,430, IC-95 %: 0,608-3,363, I2: 60,8 %, p=0,013). Es importante tener en consideración que ellos valoraron la evidencia de moderada, en el primer caso, y de baja, en el segundo. Los estudios empleados para realizar este análisis fueron muy heterogéneos, lo que le resta valor a este resultado. Estos investigadores señalaban como conclusión adicional, que el tratamiento adyuvante en estos pacientes fue efectivo reduciendo las diferencias en cuanto a SLE, en los pacientes en los cuales la resección fue R1 y aquellos en los que fue R0.
Según lo señalado por varios expertos, los principales sitios de metástasis de los GIST son hígado y peritoneo.30 En nuestra serie, el 9,7 % de los casos desarrollaron metástasis después de la cirugía, y la localización más frecuente fue el hígado. El 35,7 % de los pacientes presentaron metástasis en más de un sitio, y en todos los casos se trató de la combinación hígado más peritoneo.
En el trabajo de Borunda y cols.,20 que incluye pacientes con enfermedad metastásica se observa que el principal sitio metastásico fue también el hígado. En los estudios deMedrano y cols.1 y de Jason K y cols., 31 también el hígado constituyó el sitio metastásico más frecuente, seguido del peritoneo.
En conclusión, este trabajo constituye el primer informe epidemiológico sobre tumores del estroma gastrointestinal en Cuba, que brinda una pormenorizada información del comportamiento de esta enfermedad en el llamado "mundo real", a partir de una experiencia de protocolización centralizada que caracteriza desde el punto de vista clínico y anatomopatológico a los pacientes con tumores del estroma gastrointestinal en etapas no metastásicas.
Limitaciones
El presente trabajo
presenta las limitaciones inherentes a los estudios retrospectivos (independientemente
de contar con una base de datos sólida y bien estructurada), y constituye
el primer informe epidemiológico sobre GIST en Cuba, que brinda una pormenorizada
información del comportamiento de esta enfermedad en las circunstancias
del llamado "mundo real", a partir de una experiencia de protocolización
centralizada, con un equipo estable de trabajo para la evaluación y tratamiento
de este tipo de pacientes, que ha permitido contar con una mayor experiencia
en el manejo de este tumor, y por esta razón, a pesar de ser una enfermedad
de muy baja incidencia, se ha podido diagnosticar y tratar un alto número
de pacientes, comparables con naciones que proporcionalmente tienen poblaciones
más numerosas que nosotros.
Conflicto de intereses
Los autores declaran que no hubo conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Medrano R, Kinakú N, Rodriguez J. Factores pronósticos de recurrencia y supervivencia en tumores del estroma gastrointestinal. Gac Mex Oncol. 2015;14:259-67.
2. Kindblom LG, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal pacemaker cell tumor (GIPACT): gastrointestinal stromal tumors show phenotypic characteristics of the interstitial cells of Cajal. Am J Pathol. 1998;152:1259-69.
3. Giuliano K, Nagarajan N, Canner J. Gastric and small intestine gastrointestinal stromal tumors: do outcomes differ? J Surg Oncol. 2017;115:351-7. PubMed:PMID:27885685.
4. Hua Y, Hua X, Qi Z. Prognostic role ok the primary tumor site in patients with operable small intestine and gastrointestinal stromal tumors: a large population-based analysis. Oncotarget. 2017;9:8147-54. PubMed:PMID:29487722.
5. DeMatteo RP, Lewis JJ, Leung D, Mudan SS, Woodruff JM, Brennan MF. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surg. 2000;231:51-8.
6. Zhou J, Yan T, Huang Z. Clinical features and prognosis of gastrointestinal stromal tumors. Int J Clin Exp Med. 2016; 9:16367-72.
7. Søreide K, Sandvik OM, Søreide JA, Giljaca V, Jureckova A, Bulusu R. Global epidemiology of gastrointestinal stromal tumours (GIST): a systematic review of population-based cohort studies. Cancer Epidemiol. 2016;40:39-46. PubMed:PMID:26618334.
8. Nishida T, Blay JY, Hirota S, Kitagawa Y, Kang YK. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer. 2016;19:3-14. PubMed:PMID: 26276366.
9. Nishida T, Goto O, Raut CP, Yahagi N. Diagnostic and treatment strategy for small gastrointestinal stromal tumors. Cancer. 2016;122:3110-18. PubMed:PMID:27478963.
10. Nishida T, Tsujimoto M, Takahashi T, Hirota S, Blay JY, Wataya-Kaneda M. Gastrointestinal stromal tumors in Japanese patients with neurofibromatosis type I. J Gastroenterol. 2016;51:571-8. PubMed:PMID:26511941.
11. Lima M, Soriano JL, Batista N. Sarcomas del estroma gastrointestinal (GIST). En: Manual de Prácticas Médicas. 4ta ed. La Habana: Editorial de Ciencias Médicas; 2012. p.682-98.
12. Grace L, James D, Martinez M. Epidemiology of gastrointestinal stromal tumors in the era of histology codes: results of a population-based study. Cancer Epidemiol Biomarkers Prev. 2015;24:298-302. PubMed:PMID:25277795.
13. Jiehua L, Haitian Z, Zhibai C. Clinico-pathological characteristics and prognostic factors ok gastrointestinal stromal tumors. Int J Clin Exp Pathol. 2015;8:15969-76. PubMed:PMID:26884871.
14. Bülbül Doğusoy G. Gastrointestinal stromal tumors: a multicenter study of 1160 Turkish cases. Turk J Gastroenterol. 2012;23:203-11.
15. Brady West D, Blake G. Clinicopathological features and outcome of gastrointestinal stromal tumors in an Afro-Caribbean population. J Natl Med Assoc. 2015;104:72-7.
16. Bhalgami R, Manish K, Patil P, Mehta S, Mohandas KM. Clinicopathological study of 113 gastrointestinal stromal tumors. Indian J Gastroenterol. 2013;32:22-7.
17. Sapalidis K, Panteli N, Strati T, Anastasiadis I, Kanellos I. Surgical management of gastrointestinal stromal tumors: a single centre's experience. Hippokratia. 2015;19:73-5. PubMed:PMID:26435652.
18. Arolfo S, Teggia PM, Nano M. Gastrointestinal stromal tumors: thirty years' experience of an Institution. World J Gastroenterol. 2013;17:1836-9.
19. Wang M, Xu J, Zhang Y, Tu L, Qiu WQ, Wang CJ. Gastrointestinal stromal tumor: 15-years' experience in a single center. BMC Surg. 2014;14:ID4277251.
20. Dip Borunda AK, Pimentel Renteria A, Pluma Jiménez M, Pérez Martínez M, Martínez Martínez G, Rivera Rivera S. Treatment of non-resectable and metastatic gastrointestinal stromal tumors: experience with the use of tyrosine kinase inhibitors in a third level hospital in Mexico. J Gastrointest Oncol. 2016;7:632-7. PubMed:PMID:27563455.
21. Kindblom LG, Meis-Kindblom J, Bumming P, Dimitrijevic S, Miret M, Dortok A. Incidence, prevalence, phenotype and biologic spectrum of gastrointestinal stromal cell tumors (GIST). A population-based study of 600 cases. Ann Oncol. 2002;13(Suppl 5):s157-64.
22. Carrillo R, Candia A, Rodriguez Peralto JL, Caz V. Prognostic significance of DNA ploidy and proliferative index (MIB-1 index) in gastrointestinal stromal tumors. Hum Pathol. 1997;28:160-5.
23. Zhao WY, Xu J, Wang M, Zhang ZZ, Tu L, Wang CJ. Prognostic value of Ki 67 index in gastrointestinal stromal tumors. Int J Clin Exp Pathol. 2014;7:2298-304.
24. Lu C, Liu L, Wu X, Xu W. CD133 and Ki-67 expression is associated with gastrointestinal stromal tumor prognosis. Oncol Lett. 2013;6:1289-94.
25. Bejarano Glez-Serna D, González Benjumea P, Rodríguez Padilla AR, Balongo García R. Tumores del estroma gastrointestinal. Revisión de nuestra experiencia. Rev Chil Cir. 2014;67:386-92.
26. McCarter MD, Antonescu CR, Ballman KV, Maki RG, Pisters PW, Demetri GD. Microscopically positive margins for primary gastrointestinal stromal tumors: analysis of risk factors and tumor recurrence. J Am Coll Surg. 2012;215:53-9.
27. Joensuu H. Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Hum Pathol. 2008;39:1411-9.
28. Sugase T, Takahashi T, Nakajima K. Clinicopathological characteristics surgery and survival outcomes of patients with gastrointestinal stromal tumors. Digestion. 2016;94:30-6.
29. Zhi X, Jiang B, Yu J, Røe OD, Qin J, Ni Q. Prognostic role of microscopically positive margins for primary gastrointestinal stromal tumors: a systematic review and meta-analysis. Sci Rep. 2016;6:21541-8. PubMed:PMID:26891953.
30. Al-Kalaawy M, El-Zohairy MA, Mostafa A, Al-Kalaawy A, El-Sebae H. Gastrointestinal stromal tumors (GISTs), 10-year experience: Patterns of failure and prognostic factors for survival of 127 patients. J Egyp Nat Cancer Inst. 2012;24:31-9.
31. Jason K, Lopez N. Optimizing surgical and imatinib therapy of the treatment of gastrointestinal stromal tumors. J Gastrointest Surg. 2013;17:1997-2006.
Recibido: 20/12/2017
Aprobado: 06/02/2018
Dra. Vilma Fleites
Calvo. Hospital "Hermanos Ameijeiras". La Habana, Cuba.
Dirección
electrónica: vfleites@infomed.sld.cu