ARTÍCULO ORIGINAL
Calidad de vida en pacientes con metástasis óseas por cáncer de mama tratadas con ácido zoledrónico
Quality of life in patients with bone metastases from breast cancer treated with zoledronic acid
Iván Ramón Concepción1, Jorge L. Soriano García, Noyde Batista Albuerne, Mayté Lima Pérez, Dunia Morales Morgado, Vilma Fleites Calvo
Servicio de Oncología Clínica. Hospital "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción: Las metástasis óseas por cáncer
de mama afectan la calidad de vida relacionada con la salud (CVRS), la cual
puede beneficiarse con el uso de bifosfonatos.
Métodos: Se evaluaron 307 pacientes con metástasis óseas
por cáncer de mama (2010-2015), edades 18 - 80 años, ECOG ?3,
expectativa >6 meses, función normal de órganos/ médula
ósea, seguimiento 12 meses. Se administró ácido zoledrónico
cada 21 o 28 días, y el cuestionario EORTC QLQ-BM22 evaluó la
CVRS antes del inicio del tratamiento y a los 12 meses, se analizaron los porcentajes,
la media con su intervalo de confianza (IC) de 95 %, y se compararon en los
diferentes momentos mediante el test de Wilcoxon.
Resultados: Las pacientes ?50 años de edad constituyeron el 69
%; las posmenopáusicas, el 62,21 %; el diagnóstico de carcinoma
ductal hormonosensible, 79,15 %. Se observaron lesiones óseas mixtas
en el 65,4 %, en <3 sitios el 86,9 %, localizadas en las vértebras
el 57 % y los eventos esqueléticos fueron infrecuentes. A 12 meses del
seguimiento, se observó disminución de la puntuación del
cuestionario EORTC QLQ-BM22 en los aspectos referentes al dolor y la repercusión
psicosocial pero la interferencia funcional no mostró diferencias significativas.
Conclusiones: El tratamiento con ácido zoledrónico beneficia
la CVRS de pacientes con metástasis óseas por cáncer de
mama.
Palabras clave: Calidad de vida; ácido zoledrónico; metástasis óseas; cáncer de mama.
ABSTRACT
Introduction:
Bone metastases from cancer affect the health related quality of life (HRQL),
but it benefits with zoledronic acid.
Methods: Were evaluated 307 patients diagnosed with bone metastases from
breast cancer (2011-2013), age 18-80 years, ECOG ?3, expectancy >6 months,
normal function of bone marrow/ organs, patients' follow-up for 12 months. Zoledronic
acid administered each 21/28 days was the treatment used in this patients, and
EORTC QLQ - BM22 module assessed HRQL.
Results: Were observed more patients aged ?50 years (69 %), postmenopausal
in 62.21 %, the ductal carcinoma hormonsensitive 79.15 %.Although mixed osseous
lesionspresented in 65.4 %,
<3 osseous sites in 86.9 %, and metastases in vertebras 57 %, skeletal related
events were infrequent. At 12 months, zoledronic acid achieved better HRQL as
were observed significant reduction in pain relating scales and psychosocial
aspects, but non-in the functional interference.
Conclusions: Zoledronic acid treatment benefits HRQL in patients with
bone metastases from breast cancer.
Keywords: Health related quality of life; zoledronic acid; bone metastases; breast cancer.
INTRODUCCIÓN
El carcinoma de
mama es una de las primeras causas de muerte por cáncer en mujeres de
países menos desarrollados. En Cuba, constituye la segunda causa de incidencia
y de mortalidad por tipos de cáncer en mujeres hasta 2016. En el 70 %
de las defunciones por cáncer de mama (CM) prevalecen las metástasis
óseas (MO), y de ellas, 50 % por recurrencias. Algunos indicadores de
la recurrencia y metástasis incluyen la edad, el estadio, la expresión
de receptores hormonales y los tratamientos contra el cáncer.1-11
La fisiopatología
de las metástasis óseas incluye el incremento de la remodelación
ósea, un desequilibrio y un desacoplamiento de los procesos de resorción,
donde los osteoclastos son los principales responsables, en un complejo ciclo
osteolítico que implica al péptido de la hormona relacionada con
la paratiroides (PTHrP), el receptor activador del factor nuclear (NF)-?B ligando
RANK-L, la osteoprotegerina (OPG), el factor de crecimiento transformante beta
(TGF-b) y muchos otros factores de transcripción. El ácido zoledrónico
pertenece a la tercera generación de bifosfonatos y es un potente inhibidor
de la resorción mediada por osteoclastos, ampliamente utilizado en el
tratamiento de la osteolisis secundaria a metástasis óseas por
cáncer de mama.
Los biomarcadores predictivos y de pronóstico guían el tratamiento si se expresan en el tumor primario. Además, identifican la eficacia del AZ en relación con la progresión y resistencia de la enfermedad.
Los bifosfonatos
reducen el riesgo de metástasis óseas y benefician la supervivencia
general en el CM temprano. Además, mejoran la supervivencia global y
libre de enfermedad en mujeres posmenopáusicas. En el caso de MO por
CM, reducen el riesgo de desarrollar eventos relacionados con el esqueleto (ERE),
retrasan el tiempo medio hasta un ERE y reducen el dolor óseo.12-20
Estudios recientes
indican que las pacientes con MO por CM deben tratarse con agentes modificadores
del tejido óseo, como el ácido zoledrónico cada 12 semanas
o cada 3 a 4 semanas. Aunque sus efectos analgésicos son modestos, por
lo que no deben usarse solos para el dolor óseo, se recomienda aplicar
el estándar actual para el tratamiento de soporte y del dolor.
El aumento de la supervivencia en las pacientes con cáncer de mama ayudaría a conocer su comportamiento, por lo que sería factible aumentar el conocimiento sobre la magnitud del beneficio que puede tener el tratamiento con AZ sobre la resorción ósea en la modificación de la CVRS.14-22
MÉTODOS
Se realizó un estudio prospectivo no aleatorizado (2010-2015) que evaluó a 382 pacientes con MO por CM en el Hospital Hermanos Ameijeiras (HHA), de ellas 307 cumplieron los criterios de inclusión: confirmación histológica de CM, presencia de MO, edad entre18 y 80 años, buen estado general (*ECOG <3), expectativa de vida >6 meses, función normal de órganos y médula ósea, que no se encontraran recibiendo quimioterapia y seguimiento mínimo de 12 meses, en las pacientes de la muestra seleccionada se evaluó el efecto del AZ en la CVRS con el cuestionario del módulo EORTC QLQ-BM22.
Se identificaron subtipos biológicos del cáncer de mama y estadio al diagnóstico, y los resultados de ultrasonido abdominal, gammagrafía ósea, TAC abdominal y/o de tórax, survey óseo y RMN. El tratamiento consistió en ácido zoledrónico cada 3 o 4 semanas hasta la progresión de la enfermedad o deterioro funcional.22
La cirugía, la radioterapia antiálgica para el hueso, la fractura patológica, compresión medular, e hipercalcemia se consideraron ERE.
Se evaluó la CVRS con el cuestionario EORTC QLQ-BM22 antes de iniciar el tratamiento con AZ y a los 12 meses de seguimiento.23
En el análisis
estadístico de los resultados del estudio se utilizaron los porcentajes,
la media con su intervalo de confianza (IC) de 95 % y para la comparación
de las mismas en los diferentes momentos la prueba de rangos con signos de Wilcoxon.
Se realizó el consentimiento informado que firmaron las pacientes, a las que se les informó detalladamente en la consulta las características del estudio antes del inicio de la evaluación, así como la obtención de datos en el cuestionario del módulo EORTC QLQ-BM22, las pacientes respondieron la encuesta en la sala de espera de la consulta y se respetaron los principios bioéticos de autonomía, beneficencia y justicia durante la investigación.
RESULTADOS
Fueron estudiadas 307 pacientes con diagnóstico de metástasis óseas por cáncer de mama. La tabla 1 muestra las características clínicas basales de la totalidad de las pacientes incluidas en el estudio. El 69,0 % de las pacientes tenían ?50 años de edad, con una mediana de 59 años. La mayoría tuvo ECOG 1 (58,9 %), 62,2 % posmenopáusicas, enfermedad luminalhormonosensible en el 79,2 %, y grado nuclear III en un 52,8 %. Las metástasis óseas en cuanto a su distribución, se presentaron de forma limitada (<3 sitios) en el 86,9 % de las pacientes, con 65,4 % de lesiones mixtas, 57,0 % localizadas en vértebras. No se evidenciaron metástasis viscerales en un 53,1 % de las pacientes.
Tabla
1. Características
basales de las pacientes con metástasis óseas por cáncer
de mama
|
Grupos de edades |
#( %) |
|
|
Menor de 50 años |
95(30,94) |
|
|
50-70 años |
162(52,76) |
|
|
Mayor de 70 años |
50(16,28) |
|
|
Estado Menopáusico |
Premenopáusicas |
116(37,78) |
|
Posmenopáusicas |
191(62,21) |
|
|
ECOG (Eastern Cooperative Oncology Group) |
0 |
107(34,80) |
|
1 |
181(58,90) |
|
|
2 |
16(6,18) |
|
|
3 |
3(0,97) |
|
|
Histología |
Carcinoma ductal infiltrante |
242(78,82) |
|
Carcinoma lobulillar infiltrante |
19(6,18) |
|
|
Ductolobulillar |
46(14,90) |
|
|
Diferenciación |
Grado I |
23(7,49) |
|
Grado II |
122(39,73) |
|
|
Grado III |
162(52,76) |
|
|
Inmunofenotipos |
Luminal A-like |
37(12,05) |
|
Luminal B-like Her2 negativo |
178(57,98) |
|
|
Luminal B-like Her2 positivo |
28(09,12) |
|
|
Sobreexpresión Her2 |
27(8,79) |
|
|
Triple Negativo |
37(12,05) |
|
|
Cantidad de sitios óseos metastásicos |
Menos de 3 sitios |
266(86,9 ) |
|
Más de 3 sitios |
41(13,35) |
|
|
Localización de las metástasis óseas |
Vertebrales |
174(57,0) |
|
Extravertebrales |
133(43,3) |
|
|
Tipo de lesión ósea |
Lesiones líticas |
56(18,2) |
|
Lesiones blásticas |
50(16,2) |
|
|
Lesiones mixtas |
201(65,47) |
|
|
Presesentación metastásica |
Metástasis óseas únicas |
163(53,14) |
|
Metástasis óseas y viscerales |
144(46,86) |
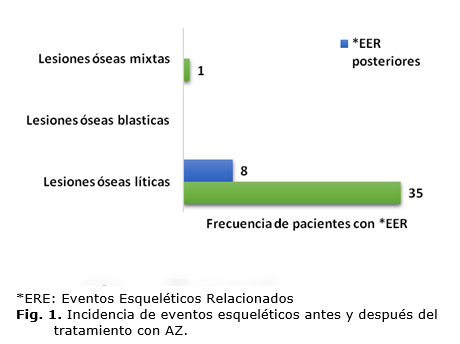
Se identificaron 36 pacientes (11,7 %) con ERE previos al AZ (se reportó fractura patológica, compresión medular, cirugía sobre el hueso y RT), en casi la totalidad se manifestaron lesiones líticas. Los ERE posteriores, dados solamente por el uso de RT antiálgica se presentaron en 8 pacientes (2,6 %) con lesiones óseas líticas. No se observaron casos de hipercalcemia maligna (fig. 1).
La estimación de medias del módulo EORTC QLQ-BM22 al comenzar el tratamiento con AZ para las subescalas sitios dolorosos y características del dolor fueron 3,42 (IC de 95 %: 2,92 - 3,92) y 3,51 (IC de 95 %: 3,0 - 4,0) respectivamente, y a los 12 meses: 1,48 (IC de 95 %: 0,37 - 2,58), y 1,94 (IC de 95 %: 0,92 - 2,95), lo cual se consideró significativo (p=0,01) para las pacientes de la muestra. Al iniciar el tratamiento con AZ, las medias en la interferencia funcional y los aspectos psicosociales 3,26 (IC de 95 %: 2,56 - 3,72) y 3,40 (IC de 95 %: 2,98 - 3,99), a los 12 meses 3,78 (IC de 95 %: 3,66 - 3,89) y 1,94 (IC de 95 %: 1,32 - 2,55), respectivamente. Aunque este último dato también resultó significativo (p= 0,01), por lo cual se demostró que la variable interferencia funcional no se modificó después de la intervención con el bifosfonato en la población estudiada de pacientes con MO por CM. Sin embargo, sí se observó un beneficio en los aspectos psicosociales después de aplicar el cuestionario EORTC QLQ-BM22 (fig. 2).
En la tabla 2 se observala descripción de las características basales (color azul) y a 12 meses (color verde) después del tratamiento con ácido zoledrónico.
DISCUSIÓN
Las características de las pacientes con cáncer de mama en este estudio prospectivo, manifestaron heterogeneidad al diagnóstico de las metástasis óseas, y padecieron algún grado de afectación de la CVRS, la cual se modificó significativamente en el transcurso de los 12 meses de tratamiento con AZ.
Un estudio retrospectivo
investigó la correlación entre el organotropismo del cáncer
de mama y la expresión de: receptor de estrógeno (RE), receptor
del factor de crecimiento epidérmico humano Her2 (Her2), y el índice
de proliferación evaluado por tinción de Ki67, y dentro de los
resultados, encontraron que los tumores con RE positivo, Her2 negativo y Ki67
positivo >13 % estaban asociados con alta incidencia de metástasis
óseas.24
Entre de los factores
clínicos y biológicos del cáncer de mama metastásico,
durante la evaluación del tratamiento con AZ, más de la mitad
de las pacientes tenían más de 50 años, eran posmenopáusicas
con buen estado general (ECOG 1), carcinoma ductal grado III, luminal B sin
sobreexpresión de Her2, con etapa III al debut y metástasis óseas
sin evidencia de otras en vísceras. El estudio observó en este
grupo de pacientes con cáncer de mama hormonosensible, un comportamiento
menos agresivo cuando solo hay metástasis en el hueso. Al añadir
el AZ junto con el tratamiento hormonal, mejoró el estado funcional,
y se extendieron los beneficios sobre la CVRS.
La mayoría
de la muestra manifestó diseminación ósea en menos de tres
sitios, la presentación mixta (lesiones líticas y blásticas)
y el sitio de localización en la columna vertebral. La incidencia de
los eventos esqueléticos relacionados (ERE) fue baja, lo que se debe
a la intervención oportuna con el AZ. El uso de radioterapia antiálgica
fue necesario y se consideró como el único ERE posterior al uso
de AZ. Sin embargo, se evitaron otras comorbilidades óseas más
severas, lo cual repercutió en mayor beneficio sobre la CVRS, mediante
la prevención de fracturas, disminución del dolor asociado con
las metástasis óseas, y se evitó el incremento de la administración
de narcóticos.
La evaluación
del riesgo de ERE se puede estimar mediante factores como las cifras de N-telopéptido
(uNTx) en la orina, la cual no es una práctica rutinaria en todos los
pacientes, pero al caracterizar el tipo de lesión ósea, se observa
que las lesiones líticas están asociadas a un incremento del riesgo.
Asimismo, al comparar
los datos obtenidos con los de un estudio multicéntrico prospectivo de
pacientes con metástasis óseas por cáncer de mama que recibieron
tratamiento con inhibidores de la resorción ósea (bifosfonatos
y denosumab), en aquel también se observó mayor porcentaje de
mujeres posmenopáusicas mayores de 50 años, el subtipo de tumores
con RE positivo, no metastásico al debut, el diagnóstico de metástasis
óseas sin metástasis viscerales asociadas, y concluyó que
el bifosfonato más utilizado y con mejores resultados fue el ácido
zoledrónico, en su diseño no estaba incluida la evaluación
de la CVRS, pero si demostró que el uso de tratamiento con bifosfonatos
redujo la aparición de ERE.25
Como puede observarse
en la fig. 2, el corto intervalo en la interferencia funcional dentro de las
puntuaciones reportadas por las pacientes, indicó muy significativamente
la ausencia de modificación del bienestar funcional.
Un estudio realizado
previamente por nuestro grupo de trabajo, en el mismo hospital, con afinidad
en el diseño, obtuvo resultados muy similares en cuanto a las características
de las pacientes y en cuanto a la repercusión del bifosfonato sobre el
dolor y los ERE, es por eso que surgió la necesidad de evaluar la CVRS
a partir del estudio actual.26
La validez y confiabilidad
del cuestionario EORTC QLQ-BM22, y los resultados de la evaluación de
la CVRS en las pacientes con enfermedad ósea secundaria al cáncer
de mama incluidas en este estudio, se sustentan con ensayos clínicos
multicéntricos internacionales específicos para pacientes con
metástasis óseas, que recibieron diferentes tratamientos, y demostraron
por medio del instrumento específico la modificación de la CVRS.22
Un estudio multicéntrico
prospectivo realizado en un número similar de pacientes con diagnóstico
de metástasis óseas por cáncer de mama que recibieron tratamiento
con ácido zoledrónico, en las que se evaluó la CVRS por
medio del cuestionario EORTC QLQ-BM22 con un seguimiento de 24 meses no reportó
cambios significativos en la escala funcional (interferencia funcional y aspectos
psicosociales). Pero, notó reducción significativa en la escala
de síntomas después del tratamiento, cuando comparó los
resultados con los de las características basales de las pacientes. La
subescala de sitio doloroso, se redujo significativamente durante los primeros
12 meses con excepción de los primeros 6 meses del seguimiento. La subescala
de características del dolor también resultó significativamente
más baja, a partir del segundo mes de tratamiento, al comparar con las
características basales. Como conclusión, el estudio demostró
que el AZ mejoró la CVRS de las pacientes con metástasis óseas
por cáncer de mama a través de la disminución del dolor
óseo después de aplicar el EORTC QLQ-BM22.27
Al comparar el
trabajo anterior con este estudio, se encontraron algunas similitudes, pues
en ambos se procuró desde antes del tratamiento con AZ hacer énfasis
en el bienestar físico, funcional, emocional y psicosocial, mediante
la aplicación del cuestionario EORTC QLQ-BM22, que indicó una
afectación significativa de la calidad de vida, fundamentalmente en los
primeros ocho acápites que conciernen a la escala de síntomas
y que se agruparon en dos subescalas (sitios dolorosos y características
del dolor). Pero, se observaron diferencias, pues en este estudio se apreciaron
modificaciones desfavorables significativas en los aspectos psicosociales antes
del AZ.
La subescala que
relaciona los sitios dolorosos (acápites del uno al cinco) caracterizó
el dolor en múltiples sitios y principalmente a nivel de la "espalda"
antes del uso de AZ, lo cual coincide con el patrón más común
que se observó en la distribución de las MO en vértebras,
a través de los diferentes segmentos del esqueleto axial. Antes del uso
de AZ, la segunda escala de síntomas que resumió (acápites
desde el seis al ocho) las características del dolor, indicó la
mayor intensidad del mismo identificada como "mucho dolor", en la
mayoría de las pacientes de forma "constante", y aunque en
pocos casos no se aliviaba, se recomendó el uso de radioterapia antiálgica
desde el comienzo de la administración del AZ y se clasificaron como
ERE previos al AZ.
Al final del seguimiento
por 12 meses con el uso de AZ, las pacientes reportaron puntuaciones bajas,
con respecto al número de sitios dolorosos, por la disminución
significativa del dolor en menor cantidad de sitios, y en algunos desapareció
totalmente, lo cual repercutió en una mejoría importante de la
CVRS, sobre el bienestar físico, y resultó en una menor frecuencia
del uso de opiáceos y de radioterapia antiálgica en las pacientes,
que fue el único ERE observado posterior al uso de AZ.
Se analizaron los
resultados de las dos escalas funcionales antes del inicio del tratamiento con
AZ. En el caso de la escala que tomó en cuenta el bienestar emocional
y psicosocial de las pacientes (los últimos seis acápites de la
encuesta), encontró "mucha" preocupación por la posible
pérdida de la independencia en el futuro, así como la falta de
optimismo. Pero después del tratamiento con AZ expresaron menos preocupación,
excepto en aquellas pocas pacientes que recibieron radioterapia antiálgica
y las que mantuvieron el uso de opiáceos, aunque constituyó una
población muy pequeña.
Una explicación
para esta observación es que la respuesta progresiva durante los 12 meses
de seguimiento con el uso del ácido zoledrónico, permite más
fácilmente que las pacientes noten una mejoría en su dolor y funcionalidad.
Si estos dominios son mejorados, en el dominio psicosocial adquieren mayor eficacia
e independencia.
Sin embargo, el
análisis de la escala que evaluó el bienestar funcional dentro
de la CVRS, clasificada en el módulo EORTC QLQ-BM22 como interferencia
funcional no presentó diferencias significativas en las pacientes con
diagnóstico de metástasis óseas por cáncer de mama.
Lo cual puede estar relacionado con el diagnóstico temprano de la enfermedad
ósea, así como el predominio de la extensión de ésta
en menos de tres sitios del esqueleto y el uso del bifosfonato.
Hay que tener en
cuenta que predominaron las pacientes con cáncer de mama con características
de buen pronóstico (receptores hormonales positivos, posmenopáusicas,
ECOG 1, solo metastásicas en hueso y con menos de 3 sitios), por lo que
este patrón pudo repercutir en el resultado favorable que se obtuvo en
el seguimiento, al aplicar el cuestionario que demostró el beneficio
del AZ en la CVRS de las pacientes con metástasis óseas por cáncer
de mama.
La encuesta se comunicó respetando la autonomía de la paciente y su derecho a ser informada previamente según las normas bioéticas nacionales, pero una limitación del estudio pudo constituir la aplicación del cuestionario en el hospital de día en la sala de espera de la consulta de evaluación y no por vía telefónica para que la paciente pueda realizar por sí misma el reporte acerca de la información de su estado desde su domicilio o su lugar de trabajo, con más privacidad. A los 6 meses probablemente se hubieran encontrado beneficios en la CVRS más prematuros con la aplicación del módulo EORTC QLQ-BM22. No se dispone de instrumentos específicos nacionales validados para metástasis óseas, se trata de un instrumento que fue validado internacionalmente en múltiples idiomas, incluyendo el español, por lo que recomendamos su utilización por la factibilidad, utilidad y especificidad que demostraron los resultados del estudio.
En conclusión, el tratamiento con ácido zoledrónico beneficia la CVRS de pacientes con metástasis óseas por cáncer de mama.
Conflicto de
intereses
Los autores declaran que no hay conflicto de intereses.
REFERENCIAS BIBLIOGRÁFICAS
1. Bray F, Ren JS, Masuyer E, Ferlay J. Estimates of global cancer prevalence for 27 sites in the adult population in 2008. IntJCancer. 2013;132:1133.
2. Siegel RL, Miller
KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66:7-30. PubMed:PMID:26742998.
3. Cuba. Ministerio
de Salud Pública. Anuario Estadístico de Salud 2016. Dirección
Nacional de Estadísticas y registros MédicosLa Habana: Ministerio
de Salud Pública; 2017.
4. Miller KD, Siegel
RL, Lin CC, Mariotto AB, Kramer JL, Rowland JH, et al. Cancer treatment and
survivorship statistics, 2016. CA Cancer J Clin. 2016;66:271-89. PubMed.PMID:27253694.
5. Burg MA, Adorno
G, Lopez ED, Loerzel V, Stein K, Wallace C, et al. Current unmet needs of cancer
survivors: analysis of open-ended responses to the American Cancer Society Study
of cancer survivors II. Cancer. 2015;121:623-30. PubMed.PMID:25581252.
6. Ibrahim T. A
new emergency in oncology: bone metastases in breast cancer patients. OncolLett.
2013;6:306-10.
7. Coleman RE.
Clinical features of metastatic bone disease and risk of skeletal morbidity.
Clin Cancer Res. 2006;12:S6243-9.
8. Woolf DK, Padhani
AR, Makris A. Assessing response to treatment of bone metastases from breast
cancer: what should be the standard of care?. Ann Oncol.2015;26:1048-57. PubMed:PMID:25471332.
9. Westbrook JA,
Cairns DA, Peng J, Speirs V, Hanby AM, Holen I, et al. CAPG and GIPC1: breast
cancer biomarkers for bone metastasis development and treatment. J Natl Cancer
Inst. 2016;108:djv360. PubMed:PMID:26757732.
10. Cronin Fenton
D, Kjærsgaard A, Nørgaard M, Amelio J.Breast cancer recurrence,
bone metastases, and visceral metastases in women with stage II and III breast
cancer in Denmark. Breast Cancer Res Treat. 2018;167:517-28. PubMed.PMID:28948396.
11. Liede A, Jerzak
KJ, Hernandez RK, Wade SW. The incidence of bone metastasis after early-stage
breast cancer in Canada. Breast Cancer Res Treat.2016;156:587-95. PubMed:PMID:27083181.
12. Brook N, Brook
E, Dharmarajan A, Dass CR, Chan A. Breast cancer bone metastases: pathogenesis
and therapeutic targets. Int J BiochemCell Biol. 2018;96:63-78. PubMed.PMID:29309917.
13. Chen WZ, Shen
JF, Zhou Y, Chen XY. Clinical characteristics and risk factors for developing
bone metastases in patients with breast cancer. Sci Rep. 2017;7:11325. PubMed:PMID:28900285.
14. Du WX, Duan
SF, Chen JJ, Huang JF. Serum bone specific alkaline phosphatase as a biomarker
for osseous metastases in patients with malignant carcinomas: a systematic review
and meta analysis. J Cancer Res Ther. 2014;10:140-3. PubMed.PMID:25450272.
15. Fanale D, Amodeo
V, Bazan V, Insalaco L, Incorvaia L, Barraco N, et al. Can the microRNA expression
profile help to identify novel targets for zoledronic acid in breast cancer?Oncotarget.
2016;7:29321-32. PubMed.PMID:27081088.
16. Lebret T, Casas
A, Cavo M. The use of bisphosphonates in the management of bone involvement
from solid tumours and haematological malignancies - a European survey. Eur
J Cancer Care. 2017;26:e12490. PubMed.PMID:27072626.
17. O'Carrigan
B, Wong MHF, Willson ML, Stockler MR, Pavlakis N, Goodwin A. Bisphosphonates
and other bone agents for breast cancer. Cochrane Database Syst Rev. 2017;10:CD003474.
PubMed:PMID:29082518.
18. Oberguggenberger
A, Meraner V, Sztankay M, Hilbert A, Hubalek M, Holzner B, et al.Health behavior
and quality of life outcome in breast cancer survivors: prevalence rates and
predictors. Clin Breast Cancer. 2018;18:38-44. PubMed:PMID:29017754.
19. Diel IJ. Effectiveness
of bisphosphonates on bone pain and quality of life in breast cancer patients
with metastatic bone disease: a review. Support Care Cancer. 2007;15:1243.
20. Ramadas A,
Qureshi AM, Dominic NA, Botross NP, Riad A, ThirunavukArasoo VJ, et al. Socio-demography
and medical history as predictors of health-related quality of life of breast
cancer survivors. Asian Pac J Cancer Prev. 2015;16:1479-85. PubMed:PMID:25743818.
21. Van Roij J,
Fransen H, van de Poll Franse L, Zijlstra M, Raijmakers N. Measuring health-related
quality of life in patients with advanced cancer: a systematic review of self
- administered measurement instruments. Qual Life Res. 2018;10:1-19.PubMed:PMID:29427216.
22. Soriano JL,
Batista N, Lima M. Cáncer de mama localmenteavanzado, recurrente y metastásico.
En: Manual de PrácticasMédicas IV Edición. UnidadFuncional
de Tumores. Tomo 1. La Habana: Editorial CienciasMédicas; 2012.p.90-126.
23. Chow E, Nguyen
J, Zhang L, Tseng LM, Hou MF, Fairchild A, et al.International field testing
of the reliability and validity of the EORTC QLQ-BM22 module to assess health-related
quality of life in patients with bone metastases. Cancer 2012;118:1457-65.
24. SavciHeijink
CD, Halfwerk H, Hooijer GKJ, Horlings HM, Wesseling J, van de Vijver MJ. Retrospective
analysis of metastatic behaviour of breast cancer subtypes. Breast Cancer Res
Treat. 2015;150:547-57. PubMed:PMID:25820592.
25. Schröder
J, Fietz Th, Köhler A, Petersen V, Tesch H, Spring L,et al.Treatment and
pattern of bone metastases in 1094 patients with advanced breast cancer - Results
from the prospective German Tumour Registry Breast Cancer cohort study. Eur
J Cancer. 2017;79:139-48. PubMed:PMID:28494404.
26. Soriano J,
Batista N, Lima M, González J, Gutiérrez A, Luaces P. Evaluación
del uso de ácido zoledrónico en pacientes con cáncer de
mama metastásico a hueso. Rev Cubana Med. 2010;49:33-64.
27. Yeh DC, Chen DR, Chao TY, Chen SC, Wang HC, Rau KM, et al. EORTC QLQ-BM22 quality of life evaluation and pain outcome in patients with bone metastases from breast cancer treated with zoledronic acid. In Vivo. 2014;28:1001-4. PubMed:PMID:25189922.
Recibido: 04/05/2018.
Aprobado: 20/06/2018.
Dr. Iván
Ramón Concepción. Hospital "Hermanos Ameijeiras".
La Habana, Cuba.