ARTÍCULO DE REVISIÓN
Nutrición perioperatoria
Perioperative Nutrition
Edelberto Fuentes Valdés
Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Se realiza una revisión descriptiva que intenta una puesta al día sobre las características comunes a los pacientes con enfermedades de solución quirúrgica en cuanto a los vínculos estrechos entre su estado nutricional y metabólico y la capacidad de respuesta adaptativa y regenerativa frente a la propia enfermedad y su tratamiento. Este trabajo tiene gran utilidad para la enseñanza y también interesará a muchas personas de campos afines. Es por ello que esta revisión pretende resumir información que permita evaluar la evidencia disponible en cuanto al estado nutricional de los pacientes con enfermedades de solución quirúrgica y la estrategia de intervención diagnóstica y de dietoterapia y terapia nutricional en las etapas preoperatoria, transoperatoria y posoperatoria.
Palabras clave: desnutrición; paciente quirúrgico; hipercatabolia; perioperatorio.
ABSTRACT
A descriptive review is carried out, which attempts to update the characteristics that are common to patients with diseases with a surgical solution in terms of the close links between their nutritional and metabolic status and the capacity of adaptive and regenerative response to the disease itself and its treatment. This work is very useful for teaching and will also raise the interest of many people from related fields. Therefore, this review intends to summarize the information that allows to assess the available evidence regarding the nutritional status of patients with surgical solution diseases and the strategy of diagnostic intervention and diet therapy and nutritional therapy in the preoperative, transoperative and postoperative stages.
Keywords: malnutrition; surgical patient; hypercatabolia; perioperative.
INTRODUCCIÓN
Studley, en 1936, demostró la existencia de una relación directa entre la pérdida de peso y la mortalidad posoperatoria,1 hecho que podría significar el principio del largo camino recorrido hasta alcanzar los avances actuales en la evaluación y tratamiento nutricional de los pacientes con afecciones quirúrgicas.2
Tradicionalmente, la alimentación de los pacientes después de una operación gastrointestinal (GI) comenzaba cuando se producían flatos o la defecación, que indicaban el retorno de la función intestinal. Actualmente, se recomienda comenzar la nutrición enteral temprana (NET), siempre que sea posible, porque es más fisiológica, previene las alteraciones morfológicas y funcionales del sistema digestivo y es más barata que la nutrición parenteral total (NPT).3,4
En la práctica quirúrgica se presta atención a los cuidados perioperatorios en relación con la planificación de la operación, la estratificación del riesgo cardiopulmonar y la posibilidad de complicaciones posoperatorias. Sin embargo, la evidencia actual confiere valor significativo al estado nutricional,5 por lo que en los últimos años el efecto beneficioso producido por la implementación de un régimen de nutrición perioperatoria, ha ido ganando en importancia progresivamente.5-7
La desnutrición es frecuente entre pacientes con indicación quirúrgica (40-50 %) y se relaciona con incremento de las complicaciones y de la mortalidad.8,9 Entre los años 2001 y 2014 fueron evaluados 1 664 pacientes ingresados en hospitales cubanos. Se demostró que entre 36,9 % y 41,2 % presentaban algún grado de desnutrición.10-12 En el año 2003, Barreto Penié y colaboradores13 aplicaron la Encuesta de Nutrición Hospitalaria en el Servicio de Cirugía General del Hospital "Hermanos Ameijeiras", con resultados similares a los antes citados. También señalaron que en las enfermedades malignas la frecuencia de trastornos nutricionales puede ascender hasta un 45 %, incluso en el período preoperatorio. En un grupo de pacientes con enfermedades del tubo digestivo la frecuencia de desnutrición fue del 87,8 % en casos de estenosis pilórica inflamatoria, 73,8 % para neoplasia maligna del esófago, 70 % para cáncer de páncreas y 53,4 % para tumores malignos del colon.14 Estas cifras, por sí solas, justificarían cualquier esfuerzo dirigido a mejorar los conocimientos y el interés del personal médico para disminuir el impacto negativo que los trastornos nutricionales tienen sobre los resultados de la intervención quirúrgica.
Es por ello que esta revisión pretende resumir información que permita evaluar la evidencia disponible en cuanto al estado nutricional de los pacientes con enfermedades de solución quirúrgica y la estrategia de intervención diagnóstica en las etapas preoperatoria, transoperatoria y posoperatoria.
INTERVENCIÓN NUTRICIONAL PERIOPERATORIA
El incremento de las complicaciones y el pobre resultado quirúrgico asociado a déficit nutricional preoperatorio puede ser revertido con la optimización del estado metabólico antes de la operación.5,15-17
La identificación temprana de los pacientes desnutridos da la posibilidad de tratar, antes de la operación, las alteraciones presentes. De ahí, la importación de los protocolos para una detección temprana de la desnutrición energético-nutrimental y la preparación de los especialistas clínicos en los métodos de evaluación y tratamiento de los trastornos nutricionales. El tratamiento nutricional prescrito por endocrinólogos y especialistas en nutrición se comporta muy cercano a los estándares de las guías de práctica clínica y tiene mayor calidad, comparado con el indicado por profesionales no especializados.18
Los cambios en la alimentación durante los periodos preoperatorio y posoperatorio pueden producir una desnutrición generalizada o carencia de nutrientes específicos. Incluso, pacientes hospitalizados supuestamente bien nutridos, presentan deficiencias de ciertos nutrientes. El estado nutricional se relaciona con cada uno de los órganos y sistemas, por lo que se hace evidente que la evaluación preoperatoria debe incluir características clínicas, dietéticas, antropométricas, bioquímicas y funcionales.14 Una revisión de tal magnitud escapa a los objetivos de este artículo.
Etapa preoperatoria
El éxito de la intervención nutricional comienza en el preoperatorio, pero depende de que se complete en el posoperatorio.19. El tratamiento nutricional temprano puede atenuar la respuesta sistémica neuroendocrina, paracrina, inmunológica y funcional del huésped a diferentes tipos de agentes agresores, enfermedades graves y a las grandes operaciones.20,21
En cirugía general los pacientes que presentan los déficits nutricionales más frecuentes y graves son aquellos que padecen afecciones del tubo digestivo, principalmente malignas. Algunos tumores tienen actividad biológica intensa y afectan funciones relacionadas con la ingestión o capacidad de utilización de nutrientes, por lo que originan estados de precaquexia o caquexia, independientemente de su tamaño.22 En ancianos con varias enfermedades asociadas se observa un deterioro importante del estado nutricional.23 Por estas razones, para la presente revisión se escogieron algunas lesiones del tubo digestivo porque debido a la función misma de este sistema, se producen los trastornos nutricionales de mayor gravedad en los pacientes con enfermedades quirúrgicas de este subsistema.
Ayuno preoperatorio
El ayuno expone el organismo a estrés metabólico significativo y reduce su capacidad para enfrentar las complicaciones. Se supone que el dogma tradicional de evitar la ingestión de alimentos desde la medianoche del día antes de la operación, debe reducir el riesgo de broncoaspiración durante la inducción anestésica. Esta regla no tiene ningún sostén científico, posiblemente constituye el resultado de tradiciones y de una información aparecida en un libro de anestesia, que ha quedado constituida en una norma mundial.24 Seis horas de ayuno para sólidos y dos para líquidos claros se consideran adecuadas para reducir el riesgo de complicaciones pulmonares,25 las molestias causadas por el ayuno nocturno, y en la mañana de la operación. Asimismo, este régimen disminuye el tiempo de recuperación y el estado catabólico asociado al ayuno.26
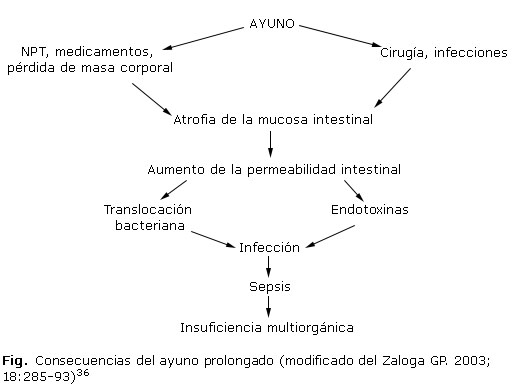
No existe ninguna enfermedad durante la cual el paciente se beneficie de la privación prolongada de alimentos. El ayuno reconoce cinco fases: 1) ayuno, hasta 14 horas después de la última ingestión de alimentos; 2) simple, hasta 24 horas; 3) breve, hasta 48 horas; 4) prolongado, hasta 72 horas y 5) inanición, cuando han transcurrido más de 96 horas. El ayuno prolongado se asocia con fracaso de la función de la barrera gastrointestinal (GI), atrofia de las microvellosidades y disminución de la masa de tejido linfoide asociada al intestino27-29 (GALT y MALT por sus siglas en inglés). La estimulación intestinal evita estos efectos, que pueden ser desencadenados por factores como: endotoxinas, radioterapia, fármacos citotóxicos e inmunosupresores, citoquinas y la nutrición parenteral, cuando no se emplea la ruta enteral.
El estado nutricional puede ser afectado por la presencia de enfermedades asociadas, el proceder quirúrgico y las complicaciones. La catabolia y la resistencia a la insulina, provocadas por las respuestas metabólica e inmunológica a la lesión, pueden ser minimizadas administrando líquidos con carbohidratos simples, los que, ingeridos antes de la operación, también disminuyen la pérdida de músculo esquelético.30 Los glúcidos, además, incrementan la función de las células beta de los islotes pancreáticos, acción que reduce la resistencia a la insulina inducida por la operación, ahorran proteínas, mejoran la función muscular y conservan la actividad inmunológica, aunque no se conoce con exactitud el mecanismo por el cual se produce este efecto.31,33
Como no hay evidencia de que el ayuno preoperatorio para líquidos disminuya el riesgo de broncoaspiración, esta conducta no solo es innecesaria sino, puede ser perjudicial, porque se producen cambios del anabolismo al catabolismo con aumento de la gluconeogénesis y la cetogénesis, reducción de la reserva de glucógeno, para satisfacer la demanda energética y pérdida de la masa magra.34,35
No obstante el conocimiento acumulado, antiguos conceptos siguen lastrando el uso de la alimentación en el preoperatorio y el posoperatorio inmediatos, desconociendo el valor de la administración de líquidos azucarados y sin residuos hasta dos horas antes de la operación. Incluso, la ingestión de una taza de café puede tener efectos benéficos para el enfermo.33-35
La desnutrición, secundaria al ayuno, produce un grupo significativo de alteraciones fisiopatológicas en el paciente quirúrgico: inhibe la producción de saliva y otras secreciones gastrointestinales y la motilidad intestinal, además, disminuye la irrigación esplácnica, reduce e inhibe la flora intestinal protectora e incrementa la virulencia de gérmenes potencialmente patógenos; así como atrofia de la mucosa del intestino delgado y del colon, que favorece el aumento de la permeabilidad intestinal, a la que se asocia la translocación bacteriana, de toxinas y de mediadores proinflamatorios.36,37
Entre las acciones deletéreas del ayuno también se cita la reducción del aporte de antioxidantes y otras sustancias que evitan el desarrollo de infecciones posoperatorias graves (Fig. 1).
Nutrición artificial (enteral y parenteral)
Aunque es probable que la mayoría de los expertos prefieran la nutrición enteral a la parenteral, los promotores de esta última parten del criterio de que la primera libera las calorías con mucha menor confiabilidad que la parenteral. Múltiples experimentos en animales permitieron concluir que los alimentos, suministrados a través del intestino, tienen un rol significativo para la preservación de la fisiología, principalmente relacionada con la función inmunológica y la inflamación sistémica.
Los beneficios teóricos de la nutrición enteral son:37
1) Conserva la mucosa intestinal y el tejido linfoide a ella asociado (MALT), el cual contiene el 65 % del tejido inmunitario y aporta más del 80 % de la producción de IgA;
2) mantiene la función inmunológica hepática y pulmonar;
3) reduce la inflamación y la fuga de antígenos desde el intestino y,
4) interfiere con la patogenicidad de gérmenes intestinales y disminuye la frecuencia de hiperglicemia.
También, favorece el balance nitrogenado, se asocia con menor frecuencia de complicaciones infecciosas posoperatorias, mejora la cicatrización de las heridas38 y minimiza la respuesta catabólica a la operación, aunque algunos niegan su valor en pacientes bien nutridos y con bajo riesgo de complicaciones nutricionales. En el cuadro se exponen las ventajas y las ventajas de ambos métodos de alimentación.
Los pacientes en UCI, alimentados por vía enteral trófica con más del 10 % del total de las calorías, tienen mejores resultados que los que reciben una cantidad menor.39 Las complicaciones más frecuentes de la nutrición enteral en pacientes con resecciones gastrointestinales (GI) son: náuseas, vómitos, distensión abdominal y diarreas, aunque no son privativos de esta modalidad nutricional.
Los pacientes con desnutrición grave y disfunción gastrointestinal, a quienes se les debe realizar intervenciones quirúrgicas complejas del tracto digestivo, se pueden beneficiar de la nutrición parenteral preoperatoria durante 7 a 10 días previos, para estabilizar el metabolismo y reducir el déficit nutricional prolongado y se mantendrá cuando el paciente no puede comer hasta después de 5 días de realizada la intervención quirúrgica. La terapia nutricional preoperatoria preferiblemente enteral es prioritaria, incluso si fuera necesario posponer la operación, pues la probabilidad de complicaciones disminuye hasta en un 50 % de los enfermos de alto riesgo.40,41 La Sociedad Norteamericana para Nutrición Enteral y Parenteral (A.S.P.E.N. siglas en inglés) recomienda la detección sistemática del riesgo nutricional en pacientes hospitalizados, su evaluación completa y tratamiento específico para los identificados en riesgo de desnutrición.42
La combinación de nutrición enteral con nutrición parenteral es superior a la nutrición enteral temprana y a la nutrición parenteral exclusiva en pacientes ancianos con cáncer digestivo, pues reduce las complicaciones posoperatorias, mejora la inmunidad y disminuye la estadía hospitalaria. Los resultados menos satisfactorios corresponden a los pacientes con nutrición parenteral exclusiva. Las diarreas pueden ser más frecuentes en el grupo de enfermos tratados con nutrición enteral precoz.43
En un metaanálisis, Gramlich y colaboradores52 encontraron que las complicaciones infecciosas fueron significativamente menores en los pacientes con NE (RR= 0,64, 95 % intervalo de frecuencia = 0,47 a 0,87 P= 0,004), pero no hubo diferencia en la mortalidad (P= 0,7) ni en el tiempo de ventilación mecánica o de estadía hospitalaria (P=0,6), aunque los datos del tiempo de ventilación mecánica y la aparición de diarreas no fueron concluyentes. La hiperglicemia fue más frecuente con el régimen de nutrición parenteral.
Algunas sustancias como la insulina, hormona de crecimiento, aminoácidos de cadena ramificada y ácidos grasos poliinsaturados (w 3) podrían mejorar la eficacia de la nutrición parenteral.
Bases de la nutrición perioperatoria
Los objetivos de la nutrición perioperatoria son:
1) minimizar el catabolismo proteico con balance nitrogenado negativo y evitar la inanición;
2) mantener las funciones muscular, visceral, inmunológica y cognitiva y,
3) favorecer la capacidad de respuesta regenerativa y recuperación posoperatoria.
El control preoperatorio de la hiperglicemia y la reducción de la resistencia a la insulina tienen alto valor para mantener el estado anabólico, mejorar la cicatrización, disminuir las complicaciones y el tiempo para la recuperación de la función intestinal y la estadía posoperatoria.38,45-46 Otro factor asociado a resultados quirúrgicos superiores es el empleo de ciclos cortos de fórmulas nutricionales inmunomoduladoras, mediante la combinación de glutamina, arginina, ácidos grasos w 3 y otros nutrientes. Este tipo de intervención es clave en la modulación de la respuesta metabólica al estrés y mejora la capacidad de cicatrización de la herida y la función inmunológica.47
En el período preoperatorio se favorecerá la ingestión oral, aunque si se considera que esta será insuficiente en el posoperatorio, se comenzará la alimentación por sonda lo más rápido posible.43
La cantidad de hidratos de carbono para alcanzar estabilidad metabólica podría ser: dextrosa al 10 o 20 % en venoclisis y dosis de 5 mg/kg/min para lograr la liberación suficiente de insulina. Actualmente, se utiliza la vía oral con 50 g de dextrosa, dosis que estimula la liberación de insulina en forma similar a la observada tras la ingestión de una comida mixta.48
Además de la resistencia a la insulina, el estrés posoperatorio causa inmunosupresión e incrementa las molestias del paciente. 49 Asimismo, la dieta con líquidos claros, días antes de la operación y hasta el posoperatorio temprano, puede producir inanición por la depleción de las reservas de glucógeno que lleva a la gluconeogénesis mediante la utilización de proteínas musculares y viscerales como sustratos energéticos. 45,50,51 Estos efectos pueden ser atenuados mediante la administración preoperatoria de bebidas ricas en carbohidratos como la maltodextrina y suero de leche, dos a tres horas antes del inicio de la operación, sobre todo en diabéticos.52
Las alteraciones del volumen plasmático son causadas por sobrecarga de agua y electrólitos durante la operación, estas empeoran los resultados quirúrgicos; de ahí que la restricción de líquidos intravenosos durante y después de la operación se asocie con reducción del riesgo quirúrgico y constituya un importante predictor de complicaciones.49,53
La resistencia a la insulina y las complicaciones disminuyen con la cirugía laparoscópica y las operaciones menores, motivo por el cual no se espera una influencia significativa de la ingestión de glúcidos sobre los resultados en estos enfermos,52 excepto la mejoría del bienestar preoperatorio.53
Las metas de la nutrición posoperatoria son: favorecer la cicatrización y evitar pérdida excesiva de masa magra, pero el comienzo a través del tubo digestivo está influenciado por la recuperación de la motilidad intestinal, la evolución quirúrgica y el deseo de cada enfermo. La recuperación de la motilidad normal del tubo digestivo es variable, de acuerdo al segmento intestinal. Así, el estómago se recupera entre 12 y 24 horas, el intestino delgado entre 6 y 12 horas y el colon entre 48 y 72. 54,55
La cirugía ambulatoria primero, y la de mínimo acceso después, fueron claves en el cambio de mentalidad en cuanto a la nutrición posoperatoria precoz, incluso el día de la operación. Clásicamente, se recomiendan regímenes de transición de alimentación modificada en consistencia y textura, con líquidos claros de inicio, seguidos de líquidos más espesos, alimentos licuados, dieta blanda, alimentos bajos en grasa y finalmente alimentos sólidos. La recuperación más rápida del intestino delgado permite utilizar la vía oral algunas horas después de la intervención quirúrgica.
La dieta con líquidos el día de una operación pulmonar es recomendable, pero estará sujeta a restricciones en relación con el estado respiratorio o la presencia de náuseas y vómitos asociados con la anestesia general y la administración de opiáceos. La extracción temprana de la sonda nasogástrica, asociada a la iniciación de la vía oral, y la progresión rápida a dieta oral disminuyen la estadía hospitalaria y los costos, sin incremento de complicaciones.46
Un metaanálisis basado en ensayos clínicos controlados 56 demostró que los pacientes tratados mediante nutrición enteral posoperatoria tuvieron disminución de cualquier tipo de infección, de la estadía hospitalaria, la dehiscencia de sutura y la mortalidad, comparados con los que no recibieron este régimen nutricional.
Los pacientes con resecciones gastrointestinales alimentados por vía proximal a la anastomosis las primeras 24 horas tras la operación, tuvieron disminución de las complicaciones, mortalidad, dehiscencia de sutura, reanudación de la función intestinal y estadía hospitalaria, comparados con las prácticas tradicionales de alimentación posoperatoria.57
La nutrición perioperatoria en intervención quirúrgica gastrointestinal
El concepto de nutrición perioperatoria comienza con la primera consulta, cuando se evalúan los riesgos nutricional y quirúrgico y continúa con la aplicación de las medidas para mejorar el estado nutricional. Durante la operación se tendrá en cuenta la necesidad de crear un acceso enteral para la alimentación/nutrición enteral (gastrostomía/yeyunostomía) en casos específicos. Una vez finalizada la intervención el control de la hidratación y de la glicemia es fundamental; como lo es el comienzo de dieta oral o enteral en el posoperatorio temprano.
Actualmente, los cuidados posoperatorios en la operación gastrointestinal están bien establecidos con el desarrollo de protocolos multimodales para la "recuperación rápida y segura después de la cirugía" (ERAS, siglas inglesas de Early Recovery After Surgery, con un antecedente cercano conocido en inglés como fast track surgery), que consisten, entre otras acciones, en la administración de hidratos de carbono hasta dos horas antes de la operación, y el comienzo de la alimentación oral o enteral en las primeras 12 a 24 horas del día de la intervención. Las sociedades norteamericana y europea para la nutrición parenteral y enteral aceptan como recomendación grado A el apoyo nutricional en pacientes operados por cáncer gastrointestinal.58-60
Nutrición inmunomoduladora
La inmunomodulación promueve una respuesta inmunológica adecuada y disminuye la liberación de sustancias proinflamatorias (proteína C reactiva e IL6) y de radicales libres.61 Se sugiere comenzar el tratamiento IM entre 5 y 7 días antes de la operación electiva y extenderlo hasta 14 días en el posoperatorio.
Los principales componentes de las fórmulas de inmunomodulación son: glutamina, arginina, ácidos grasos w 3, nucleótidos y antioxidantes.
Glutamina . Aminoácido condicionalmente esencial. Tiene un rol central en el metabolismo del nitrógeno, de las proteínas y energético. Constituye el nutriente principal para enterocitos ─células inmunológicas asociadas al intestino─ y fibroblastos, entre otras. Tiene diferentes acciones sobre la barrera mucosa intestinal y efectos anabólicos e inmunológicos y para mantener el balance antioxidativo.
La concentración sanguínea de glutamina refleja, a corto plazo, el balance entre el aporte exógeno, la liberación endógena y el consumo por órganos y células (enterocitos y células inmunocompetentes).62 Lesiones que liberan hormonas catabólicas o citoquinas inflamatorias, como las proteínas chaperonas (heat shock proteins), producen cambios en el metabolismo de aminoácidos y proteínas, incrementan el balance negativo de glutamina, favorecen el deterioro del metabolismo y la aparición de síntomas clínicos.63
El déficit de glutamina produce disminución de la síntesis proteica, pérdida de masa muscular y fatiga, y se manifiesta por la intensa reducción de los músculos, tejidos inmunológicos y la sangre.64 El riesgo de balance negativo de glutamina se asocia a traumatismos, sepsis grave con insuficiencia orgánica y necesidad de apoyo de las funciones vitales; bien por medios mecánicos o farmacológicos, por más de 72 horas.
Arginina. Además de su acción sobre los linfocitos T, participa en el proceso de cicatrización mediante el incremento de la síntesis de colágena.65 Se recomienda la administración de 15-30 g/día por vía enteral.
Ácidos grasos poliinsaturados de la serie w (3 y 6). Se caracterizan por su actividad antiinflamatoria al competir con el ácido araquidónico, el cual tiene efecto inmunosupresor e inflamatorio mediante la síntesis de tromboxanos, eicosanoides prostanoides y leucotrienos de acciones proinflamatorias, inmunodepresoras y sobre la agregación plaquetaria y el desempeño vascular. La dieta inmunomoduladora puede mejorar las fases hiperinflamatoria y compensatoria (SIRS y CARS respectivamente), asociadas con la agresión quirúrgica.66 Así, los ácidos grasos de la serie w 3, especialmente eicosapentaenoico (EPA, siglas en inglés) y docosahexaenoico (DHA, siglas en inglés), son constituyentes importantes de la inmunonutrición debido a que son precursores de eicosanoides, tromboxanos, leucotrienos y prostanoides con menores acciones deletéreas que los producidos por los ácidos grasos de la serie w 6 anteriormente descritos.65,66
Nucleótidos. Tienen funciones energéticas, metabólicas, catalíticas, reguladoras y estructurales. Participan en la reparación y la recuperación de la mucosa intestinal y en la diferenciación y proliferación de linfocitos.65,67
Las fórmulas entéricas inmunomoduladoras (contienen arginina, glutamina, ácidos nucleicos, ácidos grasos ω-3 y antioxidantes) deben ser empleadas en los pacientes que han sufrido operaciones mayores electivas, traumatismos, quemaduras y otros; con precaución en pacientes con sepsis grave (Recomendación grado A para pacientes quirúrgicos en UCI).68
Cirugía de esófago y estómago
La pérdida de peso en pacientes afectados por neoplasias malignas del esófago y el estómago se relaciona con la disminución de la ingestión y alteraciones del metabolismo causadas por la síntesis tumoral de mediadores proinflamatorios. Aunque ambos procesos pueden coincidir, en los estadios avanzados de la enfermedad las alteraciones metabólicas son las principales responsables de la respuesta inadecuada al tratamiento nutricional.69
La yeyunostomía en pacientes que sufrieron una esofagectomía, permite comenzar la nutrición enteral entre 24 y 48 horas después de la operación. La alimentación se debe iniciar con bajos volúmenes (20 mL/h) y aumentar de modo progresivo la cantidad administrada para proporcionar el total de la energía no proteica y las proteínas necesarias en las próximas 48 horas. También se puede utilizar la nutrición parenteral total, si no se realizó una yeyunostomía. Los cirujanos del grupo de Cirugía torácica del Hospital Clínico Quirúrgico "Hermanos Ameijeiras" realizamos la alimentación/nutrición temprana por yeyunostomía, siempre que no exista contraindicación absoluta para la nutrición enteral.
La ingestión oral, en estos casos, comienza después de realizar una prueba para comprobar la hermeticidad de la línea de sutura. El autor, generalmente, utiliza contraste hidrosoluble (yodado) al séptimo día del posoperatorio, otros utilizan contraste baritado. 70 Si no existe fuga del contraste a través de la línea de sutura, se comienza con líquidos claros (jugos de frutas no ácidas). Más tarde se indica leche, yogur y se añaden otros alimentos de consistencia progresivamente superior.
Una dieta rica en elementos de inmunomodulación podría controlar los efectos inmunosupresores del cáncer esofagogástrico. Algunos grupos han informado disminución de las complicaciones infecciosas y de la estadía hospitalaria al usar estos nutrientes,88,89 resultados no igualados por otros autores.71,72 Entre las causas de esta disparidad se señalan heterogeneidad de los grupos con enfermedad maligna e investigaciones con pequeño número de casos.
Los pacientes a quienes se les practica una fundoplicatura, sin complicaciones, podrán ingerir líquidos claros algunas horas después de la operación. La mayoría de los líquidos deben ser ingeridos entre las comidas y las raciones serán pequeñas, pero más frecuentes durante el día. En el posoperatorio inmediato evitarán alimentos como pan, vegetales crudos, grandes pedazos de carne y frutas, y líquidos que incrementen la producción de gas.
Wheble y colaboradores73 revisaron la que consideraron la mejor evidencia en relación con la nutrición enteral inmediata (yeyunostomía o sonda nasoyeyuynal) y compararon los resultados con los obtenidos en pacientes alimentados cuando comenzaron la vía oral. Encontraron cuatro estudios aleatorizados con un total de 243 pacientes. La nutrición enteral fue factible, pero sin evidencia de que produjera algún beneficio clínico.
En opinión de estos autores, el uso habitual de nutrición enteral posoperatoria en pacientes con una esofagectomía no está indicada. Otros señalan que a falta de datos disponibles de mayor valor, esta modalidad no debe ser abandonada en el posoperatorio, 94 opinión compartida por el autor de esta revisión.
Cirugía pancreática
La pancreatoduodenectomía con técnica de Wipple produce pérdida del marcapaso gástrico y resección parcial del páncreas, cuyas consecuencias fisiológicas se asocian con alta frecuencia de mala nutrición posoperatoria.74 Las guías europeas de nutrición recomiendan el uso de nutrición enteral después de esta técnica quirúrgica, en contraposición a las norteamericanas, las cuales recomiendan nutrición parenteral cuando no es probable que se pueda utilizar la vía oral en 7 a 10 días tras la operación, lo que no es necesariamente el caso de la pancreatoduodenectomía.75,76 No existen evidencias para usar dieta enteral o parenteral tras una técnica de Whipple, pero se acepta que la vía oral es factible en estos casos.77 Para Klek y colaboradores la nutrición enteral o parenteral, después de una operación con técnica de Whipple, se debe indicar cuando sea necesaria y no en forma habitual, aunque estos pacientes deben comenzar la vía oral tan rápido como sea posible, mientras que la nutrición parenteral solo se reservará para casos de pérdida grave de peso o en ciertas complicaciones posoperatorias como fístula pancreática.78
Se piensa que la nutrición enteral posoperatoria reduce las complicaciones y acelera la recuperación, mediante la reactivación de la función inmunológica y la reducción del riesgo de infección,74,75,78 a la vez que puede estimular la secreción pancreática y biliar.79 No existen pruebas suficientes en cuanto cuál es la mejor vía de administración. La técnica a utilizar depende de los consensos de evidencias y recomendaciones existentes, el empleo de guías prácticas vigentes y en última instancia de la experiencia y preferencia del cirujano actuante.
Las sondas nasoyeyunales para NE son instrumentos rentables, sin las complicaciones de una enterostomía adicional, además, son seguras y bien toleradas sin efectos negativos sobre la anastomosis pancreatoyeyunal,80 aunque la dislocación y la oclusión se presentan entre 35 % y 10 % respectivamente81 y las complicaciones no se asocian a pobres resultados. La oclusión se puede resolver instilando agua cada 8 h o cada vez que se administren medicamentos.82
Actualmente se propone reunir evidencias suficientes para evaluar la efectividad del protocolo ERAS para confeccionar guías en una plataforma unificada de intervención perioperatoria en los pacientes con enfermedades quirúrgicas del páncreas. Estos protocolos deberán tener un carácter multidisciplinario, interdisciplinario, multicéntrico, que permita un registro internacional de cohorte de pacientes, así como que se establezcan ensayos con diseños randomizados y bien ponderados.83
Cirugía de colon y recto
Uno de los principales problemas de la cirugía colorrectal son las complicaciones posoperatorias, sobre todo, infecciosas.84,85 En años recientes se ha evaluado la eficacia de preparaciones probióticas simples o mezclas simbióticas. Estos agentes interactúan con el sistema inmunológico del huésped. Kotzampassi y colaboradores realizaron un ensayo aleatorizado, a doble ciegas, controlado mediante placebo, para el cual utilizaron una preparación con cuatro probióticos:Lactobacillus acidophilus, Lactobacillus plantarum, Bifidobacterium lactis y Saccharomyces boulardii, administrada el día antes de la operación y en los siguientes 15 días. Obtuvieron disminución significativa de las complicaciones posoperatorias relacionadas con la ventilación mecánica, infecciones y fuga anastomótica.86,87 El mecanismo de acción de los probióticos pudiera estar relacionado con el comienzo temprano del peristaltismo intestinal y la subsecuente prevención de la traslocación bacteriana, o con la modulación de la respuesta inmunológica. Sin embargo, la utilización de uno solo no se tradujo en cambio significativo de las complicaciones posoperatorias.88
El empleo de solo 4 intervenciones básicas (retirada de sondas, tubos y drenajes, deambulación precoz, analgesia e introducción de la dieta), resultará en una recuperación posquirúrgica rápida y segura. El objetivo de la retirada de la fluidoterapia en el día 2 del posoperatorio, deambulación de más de 100 m, control de la analgesia por bomba en lugar de anestesia epidural y la introducción de la dieta en ese periodo, es la ruta clínica que difiere de los procedimientos multimodales previamente descritos por el grupo de estudio ERAS. Una mejor adherencia a los elementos del protocolo ERAS resulta crucial para mejorar los resultados quirúrgicos en este grupo de pacientes. Se hace énfasis en particular, en evitar el ayuno preoperatorio, prevenir la insulinorresistencia del transoperatorio y del posoperatorio precoz, con administración de líquidos con hidratos de carbono más suero de leche con o sin glutamina hasta 2 horas antes de la operación se ha encontrado que resultan de importancia capital para lograr resultados específicos.89
La alimentación oral temprana, durante las primeras 24 horas tras resección colorrectal, es tolerada con seguridad por entre 80 % y 90 % de los pacientes. Además, disminuye el riesgo de infección y la estadía hospitalaria y no se asocia con aumento de la dehiscencia de sutura.90
CONCLUSIONES
La presente revisión pretende despertar interés en la importancia de la intervención nutricional en el paciente con enfermedad se solución quirúrgica. Estos aspectos no solo competen al cirujano, sino a todo el equipo de salud, incluida la parte administrativa, por las implicaciones que tienen los pacientes operados con trastornos nutricionales sobre los indicadores de calidad y los resultados en forma de éxito/fracaso, con impacto sobre los costos de los sistemas de atención de salud.
La intervención nutricional en el paciente con enfermedad de solución quirúrgica debe iniciarse preoperatoriamente tan pronto se haga diagnóstico de desnutrición o se detecte riesgo nutricional, y debe continuarse en el periodo posoperatorio hasta que la recuperación sea total y exista una ingesta oral normal.
En pacientes que se les realizarán procedimientos quirúrgicos mayores, la oportunidad de ofrecer nutrición preoperatoria dependerá de la acuciosidad en la detección de la desnutrición, y de que la enfermedad y las condiciones del paciente permitan posponer el procedimiento el tiempo suficiente para implementar la terapia nutricional.
Con frecuencia pueden adicionarse suplementos nutricionales orales a la dieta normal del enfermo; otras veces se requiere suplementación a través de sondas. Si no resulta posible posponer el evento quirúrgico, la terapia nutricional deberá iniciarse en el posoperatorio tan pronto como sea posible. La decisión de emplear nutrición preoperatoria debe estar apoyada en una evaluación nutricional inicial. Es por eso que la evaluación del riesgo nutricional resulta crucial para tomar decisiones seguras y costo-efectivas.
REFERENCIAS BIBLIOGRÁFICAS
1. Studley HO. Percentage of weight loss. A basic indicator of surgical risk in patients with chronic pectic ulcer. JAMA. 1936;106(6):458-60.
2. Palesty JA, Dudrick SJ. Cachexia, malnutrition, the refeeding syndrome, and lessons from Goldilocks. Surg Clin North Am. 2011;91:653-73.
3. Johnson CD, Kudsk KA. Nutrition and intestinal mucosal immunity. Clin Nutr. 1999;18:337-44.
4. Braga M, Gianotti L, Gentilini O, Parisi V, Salis C, Di Carlo V. Early postoperative enteral nutrition improves gut oxygenation and reduces costs compared with total parenteral nutrition. Crit Care Med. 2001;29:242-8.
5. Miller KR , Wischmeyer PE , Taylor B , McClave SA . An evidence-based approach to perioperative nutrition support in the elective surgery patient. J Parenter Enteral Nutr. 2013;37(5 Suppl.):39S-50S.
6. Barrera Zepeda LM, Munguía Torres M. Terapia nutricional en el perioperatorio. En: Anaya Prado R, Arenas Márquez H, Arenas Moya D. Nutrición enteral y parenteral. 2da. ed. México: Mc Graw Hill; 2012. p. 450-4.
7. León Pérez D. Terapia intensiva: Nutrición en el paciente crítico. La Habana: ECIMED; 2013. p. 114-8.
8. Gómez Candela C, Luengo LM, Cos AI, Martínez-Roque V, Iglesias C, Zamora P, et al. Valoración global subjetiva en el paciente neoplásico. Nutr Hosp. 2003;6:353-7.
9. Bauer J , Capra S , Ferguson M . Use of the scored Patient-Generated Subjective Global Assessment (PG-SGA) as a nutrition assessment tool in patients with cancer. Eur J Clin Nutr. 2002;56(8):779-85.
10. Barreto Penié J. State of malnutrition in Cuban hospitals. Nutrition. 2005;21:487-97.
11. Santana Porbén S. Estado de la nutrición artificial en Cuba. Lecciones del estudio cubano de desnutrición hospitalaria. Nutr Clin. 2009;17:37-47.
12. Santana Porbén S. State of malnutrition in Cuban hospitals; a needed update. Nutr Hosp. 2015;31(5):1900-09.
13. Barreto Penié J, Santana Porbén S, Martínez González C, Espinosa Borrás A. Desnutrición hospitalaria: la experiencia del Hospital "Hermanos Ameijeiras". Acta Médica. 2003;11:76-95.
14. Santana Porbén S. ¿Cómo saber que el paciente quirúrgico está desnutrido? Nutr Clin. 2004;7(4):240-50.
15. Burden S , Todd C , Hill J , Lal S . Pre-operative nutrition support in patients undergoing gastrointestinal surgery. Cochrane Database Syst Rev. 2012 Nov 14;11:CD008879. doi: 10.1002/14651858.CD008879.pub2 [cited 2016 Ago 15] Available from: https://www.ncbi.nlm.nih.gov/pubmed/23152265CD008879
16. Leandro-Merhi VA, de Aquino JL, Sales Chagas JF. Nutrition status and risk factors associated with length of hospital stay for surgical patients. JPEN. 2011;35:241-8.
17. Evans DC , Martindale RG , Kiraly LN , Jones CM . Nutrition optimization prior to surgery. Nutr Clin Pract. 2014;29(1):10-21.
18. Morán López JM, Piedra León M, Enciso Izquierdo FJ, Luengo Pérez LM, Amado Señaris JA. Diferencias en estándares de calidad a la hora de pautar un soporte nutricional: diferencias entre médicos especialistas y no especialistas. Endocrinología y Nutrición. 2016;63(1):27-31.
19. McClave SA, Kozar R, Martindale RG, Heyland DK, Braga M, Carli F, et al. Summary Points and Consensus Recommendations From the North American Surgical Nutrition Summit. JPEN. 2013;37(suppl 1):99S-105S.
20. Martindale RG , Warren M , Diamond S , Kiraly L . Nutritional Therapy for Critically Ill. Nestle Nutr Inst Workshop Ser. 2015;82:103-116. [cited 2016 Ago 15] doi: 10.1159/000382007. Epub 2015 Oct 20.
21. Barreto Penié J. Respuesta al ayuno/inanición y agresión. En: Anaya Prado R, Arenas Márquez H, Arenas Moya D. Nutrición Enteral y Parenteral. 2da. ed. México: Mc Graw Hill; 2012. p. 9-18.
22. Bozzetti F, Mariani L. Defining and Classifying Cancer Cachexia: A Proposal by the SCRINIO Working Group. JPEN J Parenter Enteral Nutr. 2009;33:361-7.
23. Dexter EU. Perioperative care of the thoracic surgical patient. In: Sellke FW, del Nido PJ, Swanson SJ (eds.). Sabiston & Spencer. Surgery of the Chest. Chap. 4. Philadelphia: Saunders Elsevier; 2010. p. 47-58.
24. Maltby JR. Fasting from midnight-the history behind the dogma. Best Pract Res Clin Anaesthesiol. 2006;20(3):363-78.
25. Smith MD, McCall J, Plank L, Herbison GP, Soop M, Nygren J. Preoperative carbohydrate treatment for enhancing recovery after elective surgery. Cochrane Database Syst Rev. 2014 Aug 14;(8):CD009161 [cited 2016 Ago 25]. Available from: https://www.ncbi.nlm.nih.gov/pubmed/25121931
26. Ljungqvist O. ERAS-Enhanced Recovery After Surgery: Moving Evidence-Based Perioperative Care to Practice. JPEN J Parenteral Enteral Nutr. 2014;38(5):559-66.
27. Diks J, van Hoorn DE, Nijveldt RJ, Boelens PG, Hofman Z, Bouritius H, et al. Preoperative fasting: an outdated concept?. J Parenteral Enteral Nutr. 2005;29:298-304.
28. García de Lorenzo A. Respuesta metabólica a la agresión. Soporte nutrometabólico en el paciente grave. En: García de Lorenzo A (ed.). Soporte nutricional especializado en el paciente grave. Madrid: EDIKAMED; 2007.1-6.
29. Barreto Penié J, Velbes Marqueti PE. Inanición y agresión. En: Paniagua Estévez MA, Piñol Jiménez FN (eds.). Gastroenterología y Hepatología Clínica. La Habana: ECIMED; 2014. p. 347-62.
30. Wang ZG, Wang Q, Wang WJ, Qin HL. Randomized clinical trial to compare the effects of preoperative oral carbohydrate versus placebo on insulin resistance after colorectal surgery. Br J Surg. 2010;97(3):317-27.
31. Torgersen Z, Balters M. Perioperative nutrition. Surg Clin North Am. 2015;95(2):255-67.
32. Ljunggren S, Hahn RG, Nystrom T. Insulin sensitivity and beta cell function after carbohydrate oral loading in hip replacement surgery: a double-blind, randomised controlled clinical trial. Clin Nutr. 2014;33(3):392-8.
33. Nygren J, Thorell A, Ljungqvist O. Preoperative oral carbohydrate therapy. Curr Opin Anaesthesiol. 2015;28(3):364-9.
34. Henriksen MG, Hessov I, Dela F, Vind Hansen H, Haraldstad V, Rodt SA. Effects of preoperative oral carbohydrates and peptides on postoperative endocrine response, mobilization, nutrition and muscle function in abdominal surgery. Acta Anaesthesiol Scand. 2003;47:191-9.
35. Cestonaro T, Madalozzo Schieferdecker ME, Thieme RD, Neto Cardoso J, Ligocki Campos AC. The reality of the surgical fasting time in the era of the ERAS protocol. Nutr Hosp. 2014;29(2):437-43.
36. Zaloga GP, Roberts PR, Marik P. Feeding the Hemodynamically Unstable Patient: A Critical Evaluation of the Evidence. Nutr Clin Pract. 2003;18:285-93.
37. Seres DS, Valcarcel M, Guillaume A. Advantages of enteral nutrition over parenteral nutrition. Ther Adv Gastroenterol. 2013;6(2):157-67.
38. Schroeder D, Gillanders L, Mahr K, Hill GL. Effects of immediate postoperative enteral nutrition on body composition, muscle function, and wound healing. JPEN J Parenter Enteral Nutr. 1991;15:376-83.
39. Hsu MH , Yu YE , Tsai YM , Lee HC , Huang YC , Hsu HS . Combined enteral feeding and total parenteral nutritional support improves outcome in surgical intensive care unit patients. J Chin Med Assoc. 2012;75(9):459-63.
40. Jie B, Jiang ZM, Nolan MT, Zhu SN, Yu K, Kondrup J. Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk. Nutrition. 2012;28(10):1022-7.
41. Abunnajan S, Cuviello A, Sánchez JA. Enteral and Parenteral Nutrition in the Perioperative Period: State of the Art. Nutrients. 2013;5:608-23.
42. Mueller C, Compher C, Ellen DM. A.S.P.E.N. Clinical guidelines: Nutrition screening, assessment, and intervention in adults. JPEN J Parenteral Enteral Nutr. 2011;35(1):16-24.
43. Huang D , Sun Z , Huang J , Shen Z . Early enteral nutrition in combination with parenteral nutrition in elderly patients after surgery due to gastrointestinal cancer. Int J Clin Exp Med. 2015;8(8):13937-45.
44. Gramlich L , Kichian K , Pinilla J , Rodych NJ , Dhaliwal R , Heyland DK . Does enteral nutrition compared to parenteral nutrition result in better outcomes in critically ill adult patients? A systematic review of the literature. Nutrition. 2004;20(10):843-8.
45. Perrone F, da-Silva-Filho AC, Adôrno IF, Anabuki NT, Leal FS, Colombo T, et al. Effects of preoperative feeding with a whey protein plus carbohydrate drink on the acute phase response and insulin resistance. A randomized trial. Nutr J. 2011;10:66-72.
46. Steenhagen E. Enhanced Recovery After Surgery: It´s Time to Change Practice. Nutr Clin Pract. 2016;31:18-29.
47. Nespoli L , Coppola S , Gianotti L . The role of the enteral route and the composition of feeds in the nutritional support of malnourished surgical patients. Nutrients. 2012;4(9):1230-6.
48. Nygren J, Soop M, Thorell A, Efendic S, Nair KS, Ljungqvist O. Preoperative oral carbohydrate administration reduces postoperative insulin resistance. Clin Nutr. 1998;17(2):65-71.
49. Thorell A, Nygren J, Ljungqvist O. Insulin resistance: A marker of surgical stress. Curr Opin Clin Nutr Metab Care. 1999;2:69-78.
50. Lassen K, Coolsen MM, Slim K, Carli F, de Aguilar-Nascimento JE, Schäfer M, et al. Guidelines for perioperative care for pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS®) Society recommendations. World J Surg. 2013;37(2):240-58.
51. Noblett SE, Watson DS, Huong H, Davison B, Hainsworth PJ, Horgan AF. Pre-operative oral carbohydrate loading in colorectal surgery: A randomized controlled trial. Colorectal Dis. 2006;8:563-9.
52. Awad S, Varadhan KK, Ljungqvist O, Lobo DN. A meta-analysis of randomised controlled trials on preoperative oral carbohydrate treatment in elective surgery. Clin Nutr. 2013;32(1):34-44.
53. Enomoto TM, Larson D, Martindale RG. Patients requiring perioperative nutritional support. Med Clin North Am. 2013;97(6):1181-200.
54. Babineau TJ, Blackburn GL. Time to consider early gut feeding. Crit Care Med. 1994;22(2):191-3.
55. Warren J , Bhalla V , Cresci G . Postoperative diet advancement: surgical dogma vs. evidence-based medicine. Nutr Clin Pract. 2011;26(2):115-25.
56. Lewis SJ, Egger M, Sylvester PA, Topic SV. Early enteral feeding versus "nil by mouth" after gastrointestinal surgery: systematic review and meta-analysis of controlled trials. BMJ. 2001;33(92):153-299.
57. Osland E, Yunus RH, Khan Sh, Mamon AM. Early versus Traditional Postoperative Feeding in Patients Undergoing Resectional Gastrointestinal Surgery: A Meta-Analysis. JPEN. 2011;35(4):473-87.
58. Aguilar-Nascimento JE, Bicudo-Salomao A, Caporossi C. Enhancing surgical recovery in Central-West Brazil: The ACERTO protocol results. e-SPEN, (the European e-Journal of Clinical Nutrition and Metabolism). Eur J Clin Nutr. 2008;3(2):e78-e83.
59. Bozzetti F. Nutritional support in patients with oesophageal cancer. Support Care Cancer. 2010;18 Suppl 2:S41-S50.
60. Dock-Nascimento DB, de Aguilar-Nascimento JE, Magalhaes Faria MS, Caporossi C, Slhessarenko N, Waitzberg DL. Evaluation of the effects of a preoperative 2-hour fast with maltodextrine and glutamine on insulin resistance, acute-phase response, nitrogen balance, and serum glutathione after laparoscopic cholecystectomy: a controlled randomized trial. JPEN J Parenter Enteral Nutr. 2012;36(1):43-52.
61. Uscategui H. Inmunosupresión: Enfoque en el paciente quirúrgico. Rev Chil Cir. 2010;62(1):87-92.
62. Stehle P, Kuhn KS. Glutamine: An Obligatory Parenteral Nutrition Substrate in Critical Care Therapy. BioMed Research International. vol. 2015, Article ID 545467, 7 pages, 2015. [cited 2016 Ago 18]. Available in: http://dx.doi.org/10.1155/2015/545467doi:10.1155/2015/545467
63. Fürst P, Alteheld B, Stehle P. Why should a single nutrient-glutamine-improve outcome? The remarkable story of glutamine dipeptides. Clin Nutr. 2004 Suppl;1(1):3-15.
64. Oliveira GP, Dias CM, Pelosi P, Rocco PRM. Understanding the mechanisms of glutamine action in critically ill patients. Anais da Academia Brasileira de Ciencias. 2010;82(2):417-30.
65. Pierre JF, Heneghan AF, Lawson CM, Wischmeyer PE, Kozar RA, Kudsk KA. Pharmaconutrition review: physiological mechanisms. JPEN. 2013;37(5 Suppl):51S-65S.
66. Yaqoob P. Mechanisms underlying the immunomodulatory effects of n-3 PUFA. Proc Nutr Soc. 2010;69:311-5.
67. Hess JR, Greenberg NA. The Role of Nucleotides in the Immune and Gastrointestinal Systems: Potential Clinical Applications. Nutr Clin Pract. 2012;27:281-4.
68. Boullata JI, Carrera AL, Harvey L, Escuro AA, Hudson L, Mays A, et al. ASPEN Safe Practices for Enteral Nutrition Therapy . 2016;20:1-89.
69. Atkins BZ, Shah AS, Hutcheson KA, Mangum JH, Pappas TN, Harpole DH Jr, et al. Reducing hospital morbidity and mortality following esophagectomy. Ann Thorac Surg. 2004;78:1170-6.
70. Tanomkiat W, Galassi W. Barium sulfate as contrast medium for evaluation of postoperative anastomotic leaks. Acta Radiol. 2000;41:482-5.
71. Lobo DN, Williams RN, Welch NT, Aloysius MM, Nunes QM, Padmanabhan J, et al. Early postoperative jejunostomy feeding with an immune modulating diet in patients undergoing resectional surgery for upper gastrointestinal cancer: a prospective, randomized, controlled, double-blind study. Clin Nutr. 2006;25:716-26.
72. Sultan J, Griffin SM, Di Franco F, Kirby JA, Shenton BK, Seal CJ, et al. Randomized clinical trial of omega-3 fatty acid-supplemented enteral nutrition versus standard enteral nutrition in patients undergoing oesophagogastric cancer surgery. Brit J Surg. 2012;99:346-55.
73. Wheble GA, Benson RA, Khan OA. Is routine postoperative enteral feeding after oesophagectomy worthwhile? Interact Cardiovasc Thorac Surg. 2012 Oct;15(4):709-12.
74. Pappas S, Krzywda E, Mcdowell N. Nutrition and Pancreaticoduodenectomy. Nutr Clin Pract. 2010;25:234-43.
75. Park SJ, Chung HK, Hwang HK, Kim JK, Yoon DS. Perioperative Nutritional Effects of Early Enteral Feeding Compared with Total Parenteral Nutrition in Pancreaticoduodenectomy Patients: A Prospedctive, Randomized Study. J Korean Med Sci. 2012;27:261-7.
76. Mundi MS, Nystrom EM, Daniel L. Hurley DL, McMahon MM. Management of Parenteral Nutrition in Hospitalized Adult Patients. JPEN. 2016;20(10):1-89.
77. Gerritsen A, Besselink MG, Cieslak KP, Vriens MR, Steenhagen E, van Hillegersberg R, et al. Efficacy and complications of nasojejunal, jejunostomy and parenteral feeding after pancreaticoduodenectomy. J Gastrointest Surg. 2012;16:1144-5.
.78. Klek S, Sierzega M, Turczynowski L, Szybinski P, Szczepanek K, Kulig J. Enteral and parenteral nutrition in the conservative treatment of pancreatic fistula: a randomized clinical trial. Gastroenterology. 2011;141(1):157-63.
79. Shen Y, Jin W. Early enteral nutrition after pancreatoduodenectomy: A meta-analysis of randomized controlled trials. Langenbecks Arch Surg. 2013;398:817-23.
80. McClave SA, Taylor BE, Martindale RG, Warren MM, Johnson DR, Braunschweig C, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient. JPEN. 2016;40(2):159-211.
81. Meer JA. Inadvertent dislodgement of nasoenteral feeding tubes: incidence and prevention. JPEN J Parenter Enteral Nutr. 1987;11:187-9.
82. Nussbaum DP , Zani S , Penne K , Speicher PJ , Stinnett SS , Clary BM , et al. Feeding jejunostomy tube placement in patients undergoing pancreaticoduodenectomy: an ongoing dilemma. J Gastrointest Surg. 2014;18(10):1752-9.
83. Lassen K, Coolsen MME, Slim K, Carli F, de Aguilar-Nascimento JE, Markus Schäfer M, et al. Guidelines for Perioperative Care for Pancreaticoduodenectomy: Enhanced Recovery After Surgery (ERAS) Society Recommendations. World J Surg. 2013;37:240-58.
84. Rawlinson A , Kang P , Evans J , Khanna A . A systematic review of enhanced recovery protocols in colorectal surgery. Ann R Coll Surg Engl. 2011;93(8):583-8.
85. Sadahiro S, Suzuki T, Tanaka A. Comparison between oral antibiotics and probiotics as bowel preparation for elective colon cancer surgery to prevent infection: prospective randomized trial. Surgery. 2014;155:493-503.
86. Kotzampassi K, Stavrou G, Damoraki G, Georgitsi M, Basdanis G, Tsaousi G, et al. A Four Probiotic Regimen Reduces Postoperative complications After Colorectal Surgery: A Randomized, Double-Blind, Placebo-Controlled Study. World J Surg. 2015;39:2776-83.
87. Zhang JW , Du P , Gao J , Yang BR , Fang WJ , Ying CM . Preoperative probiotics decrease postoperative infectious complications of colorectal cancer. An J Med Sci. 2012;343:199-205.
88. Mangell P , Thorlacius H , Syk I , Ahrné S , Molin G , Olsson C , et al. Lactobacillus plantarum 299v does not reduce enteric bacteria or bacterial translocation in patients undergoing colon resection. Dig Dis Sci. 2012;57(7):1915-24.
89. Gustafsson UO, Hausel J, Thorell A, Ljungqvist O, Soop M, Nygren J. Adherence to the enhanced recovery after surgery protocol and outcomes after colorectal cancer surgery. Arch Surg. 2011;146(5):571-7.
90. Wang G, Jiang ZW, Xu J, Gong JF, Bao Y, Xie LF, et al. Fast-track rehabilitation program vs. conventional care after colorectal resection: A randomized clinical trial. World J Gastroenterol. 2011;17(5):671-6.
Recibido:
20 de septiembre de 2016.
Aprobado:
18 de noviembre de 2016.
Edelberto Fuentes Valdés. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". San Lázaro 701 e/ Marqués González y Belascoaín. Centro Habana, CP 10400. La Habana, Cuba. Correo electrónico: efuentes@infomed.sld.cu