ARTÍCULO ORIGINAL
Resistencia de cepas de Pseudomonas aeruginosa en pacientes graves
Resistance of Pseudomonas aeruginosa strains in critically-ill patients
Marcia Hart Casares, María Luisa Martínez Batista, Alba González Maestrey, Zurelys Montes de Oca Méndez
Hospital "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción:
Pseudomonas aeruginosa es un patógeno multirresistente que causa
infecciones graves en pacientes hospitalizados.
Objetivo:
determinar la resistencia de este microorganismo a los principales antimicrobianos.
Métodos:
se realizó un estudio observacional de cohorte transversal a 117 cepas
aisladas de pacientes ingresados en el Hospital ¨Hermanos Ameijeiras¨
durante los años 2015-2016.
Resultados:
la mayoría de las cepas provenían de las unidades de atención
al grave 66 (56,41 %), siendo estas en las que se encontraron el mayor porcentaje
de resistencia. Se aisló con mayor frecuencia en secreciones endotraqueales
43 (38,00 %) y hemocultivos 28 (25,00 %). Se observó que las cepas aisladas
en hemocultivos se mostraron más sensibles a las aisladas en otras fuentes
biológicas. En general, la resistencia a Ceftazidima fue de 49,57 %; Cefepime:
48,71 %; Aztreonam: 63,24 %; Gentamicina: 42,73 %; Ciprofloxacino: 54,7 %; Meropenem:
41,8 % e Imipenem: 33,33 %. Por otra parte, el Equipo Vitek2Compact detectó
que contra la familia de β-lactámicos, 40 (34,18 %) cepas, mostraban
Resistencia de alto nivel + Carbapenemes Resistentes (impermeabilidad). Para
los aminoglucósidos 50 (42,73 %) cepas, mostraron fenotipos resistentes
(GEN, NET, AMI, TOB) (GEN NET AMI). Para Quinolonas 66 (56,41 %) se comportaron
con fenotipos resistentes. Para Tetraciclina y Polipéptidos, la mayoría
de los fenotipos fueron salvajes con 116 (99,14 %) y 91 (77,77) cepas, respectivamente.
Conclusiones: las cepas analizadas mostraron niveles de resistencia muy
elevados para todos los antibióticos probados, destacando el incremento
de la misma frente a Meropenem, Imipenem y Colistina. Dentro de los fenotipos
de resistencia detectados contra la familia de β-lactámicos se destacó:
Resistencia de alto nivel + Carbapenemes Resistentes (impermeabilidad), para
los aminoglucósidos (GEN, NET, AMI, TOB) (GEN NET AMI), las Quinolonas
se comportaron con fenotipos resistentes, mientras que para Tetraciclina y Polipéptidos
la mayoría de los fenotipos fueron salvajes.
Palabras
clave: Pseudomonas aeruginosa; resistencia antimicrobiana; infección
nosocomial.
ABSTRACT
Introduction:
Pseudomonas aeruginosa is a multiresistant pathogen that causes serious
infections in hospitalized patients.
Objective:
To analyze the resistance of this microorganism to the main antimicrobials.
Methods:
An observational cross-sectional cohort study was carried out with 117 strains
isolated from patients hospitalized in Hermanos Ameijeiras Hospital during the
years 2015 and 2016.
Results:
The majority of the strains came from the critically-ill patient attention units,
66 (56.41 %), being these where the highest percentage of resistance was found.
The isolation was more frequent from endotracheal secretions, 43 (38.00 %),
and blood cultures, 28 (25.00 %). Strains isolated from blood cultures were
observed to be more sensitive than those isolated from other biological sources.
Generally speaking, resistance to ceftazidime was 49.57 %; cefepime, 48.71 %;
aztreonam, 63.24 %; gentamicin, 42.73 %; ciprofloxacin, 54.7 %; meropenem, 41.8
%; and imipenem, 33.33 %. On the other hand, the Vitek2 Compact team detected
that against the β-lactam family, 40 (34.18 %) strains showed high level
of resistance and carbapenemes resistance (impermeability). For aminoglycosides,
50 (42.73 %) strains showed resistant phenotypes (GEN, NET, AMI, TOB) (GEN NET
AMI). For quinolones, 66 (56.41 %) behaved with resistant phenotypes. For tetracycline
and polypeptides, most of the phenotypes were wild with 116 (99.14 %) and 91
(77.77 %) strains, respectively.
Conclusions:
The strains analyzed showed very high resistance levels for all the antibiotics
tested, highlighting the increase of resistance against meropenem, imipenem
and colistin. Among the resistance phenotypes detected against the β-lactam
family, the following stand out: high level of resistance and carbapenemes resistance
(impermeability); for the aminoglycosides (GEN, NET, AMI, TOB) (GEN NET AMI),
the quinolones behaved with resistant phenotypes, whereas for tetracycline and
polypeptides most phenotypes were wild.
Keywords:
Pseudomonas aeruginosa; antimicrobial resistance; nosocomial infection.
INTRODUCCIÓN
La resistencia a antimicrobianos es uno de los problemas más importantes que tiene en estos momentos la patología infecciosa, conocer los patógenos que con más frecuencia infectan a pacientes graves, así como su resistencia antibiótica y los mecanismos por los cuales estos microorganismos la producen, es uno de las objetivos más importantes que enfrentan los laboratorios de microbiología hospitalarias en estos momentos.
La Pseudomonas aeruginosa es un bacilo Gram negativo no fermentador de glucosa, que es frecuentemente aislado del suelo, las plantas y los animales que se encuentran en lugares húmedos con temperaturas entre 20-25 grados y que se ha convertido en un importante patógeno nosocomial, y representa uno de los patógenos más frecuentes aislados en infecciones del paciente ventilado.1,2
Este microorganismo posee varias propiedades que le permiten producir enfermedad: la secreción de exoenzimas, por el sistema de secreción tipo III, la cual se asocia con infecciones invasivas o más agudas, la producción de una exotoxina A que inhibe el factor 2 de elongación eucarionte, con la interrupción en la síntesis proteica y la contribución a la muerte celular en el huésped; la presencia de las proteasas alcalinas, elastasas y proteasa IV, que degradan múltiples proteínas inmonorreguladoras del huésped; y las fenacinas, como la piocianina, que producen disfunción ciliar en las vías respiratorias y efectos proinflamatorios y oxidantes que dañan las células del huésped.3
Las Pesudomonas aeruginosas presentan en este momento una elevada resistencia a numerosos antibióticos, por lo que reduce posibilidad de la terapia antimicrobiana que ayudaría a controlar y erradicar estas infecciones, este microorganismo tiene mecanismos de resistencia natural a un gran número de antimicrobianos y la capacidad de adquirir otros nuevos mediante mutaciones cromosómicas y trasmisión por plásmidos.4
La escasa permeabilidad de membrana externa y la presencia de bombas de expulsión sobre todo la MexAB-OprM, constituye su mecanismo principal intrínseco para generar resistencia a antimicrobianos de utilización en pacientes graves como carbapénemicos, además tienen cassetes de resistencia a aminoglucosidos lo cual inactiva la utilización de este grupo de antibióticos.5
En este trabajo nos propusimos determinar el comportamiento de la resistencia en cepas de Pseudomonas aeruginosa, así como los sus fenotipos de resistencia a partir de muestras aisladas.
MÉTODOS
En el hospital ¨Hermanos Ameijeiras¨ se realizó un estudio observacional de cohorte transversal a cepas aisladas desde el año 2015 al 2016 de pacientes graves hospitalizados en nuestros servicios.
Los datos fueron recogidos por el sistema de gestión hospitalario GalenLab y procesados en una base de datos en SSPS.17. Las muestras fueron procesadas siguiendo las normas establecidas por el Centro de Control de Enfermedades (CDC)6 y los procedimientos para el diagnóstico de las mismas, elaborados por el laboratorio de microbiología del hospital.7 Se utilizó para la identificación de Pseudomonas aeruginosa el equipo automatizado VITEK 2 Compact de la firma BioMériux con tarjetas ID GN, para el estudio de susceptibilidad antimicrobiana se utilizaron tarjetas AST N87. 8 Las concentraciones de los antibióticos utilizados para el estudió fueron: Ampicilina (10 µg), Ampicilina/Sulbactam (10 µg/10 µg), Piperacilina/Tazobactam (100 µg/10 µg), Cefoxitina (30 µg), Ceftazidima (30 µg), Cefepime (30 µg), Aztreonam(30 µg), Imipenem (10 µg), Meropenem (10 µg), Amikacina (30 µg), Gentamicina (10 µg), Ciprofloxacina (5 µg), Colistina (10 µg) y Tigeciclina (15 µg). El equipo trabajó con un nivel de confianza de un 95 % (p< 0,005).
Para complementar los objetivos propuestos, se analizaron las variables seleccionadas mediante el cálculo de números absolutos y porcentajes como medidas de resumen para variables cualitativas además de la prueba estadística Ji-cuadrado de Pearson como método de análisis para evaluar la asociación entre variables cualitativas. En todas las pruebas estadísticas realizadas se utilizó un nivel de significación de 0,05 y una confiabilidad del 95 %. Las diferencias fueron consideradas estadísticamente significativas cuando el valor de p fue menor que 0,05.
RESULTADOS
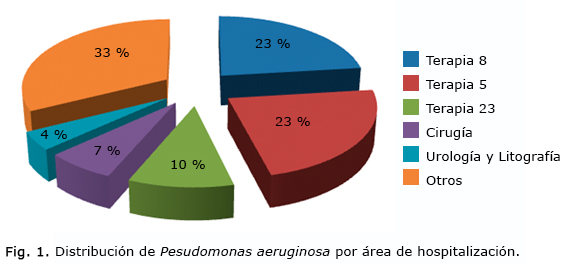
De las 117 cepas de Pseudomonas aeruginosa, 66 (56,41 %) pertenecían a las unidades de atención al grave, de ellas 27 (23 %) a la terapia del quinto piso y octavo piso respectivamente, y 12 (10 %) de la terapia del piso 23, correspondiente al servicio de Cirugía Cardiovascular, de Cirugía General, 8 (7 %), de servicios de Urología y Litotricia, 5 (10 %), y las restantes 38 cepas fueron aisladas de otros servicios, lo que representó el 33 % (fig. 1).
Las muestras estudiadas fueron: 43 (38,0 %) Cultivo de Secreciones Endotraqueales (SET) y 28 (25,0 %) hemocultivos, las restantes fueron 12 (11 %) de orina, 11 (10 %) heridas quirúrgicas, 5 (4 %) catéter, 3(4 %) LCR, 2 (2 %) heridas y se identificaron 8 cepas que se agruparon en otras, lo que representó un (7 %), (fig. 2).
El estudio de suceptibilidad
realizado mostró que 117 (100 %) de las cepas estudiadas presentó
resistencia a: Ampicillina/Sulbactam, el 94,8 (111 cepas); Ceftriaxone 74 (63,2
%); Aztreonam 58 (49,57 %), Ceftazidima 64 (54,7 %) Ciprofloxacina 57 (48,71
%) Cefepime y Amikacina; 50 (42,73 %), Gentamicina 49 (41,08 %) y 39 (33,3 %)
a Meropenem e Imipenem, respectivamente y 22 (18,8 %) a Colistina (fig.
3). La caracterización fenotípica por el sistema experto del Vitek2
Compact mostró que contra la familia de β-lactámicos 40 (34,18
%) cepas mostraban: Resistencia de alto nivel+ Carbapenemes Resistentes (impermeabilidad);
28 (23,93 %) fenotipos salvajes + Resistencia a Tícarcilina no enzimática
de bajo nivel + Penicilinasa adquirida; 11 (9,40 %) Resistencia de alto nivel
+ Carbapenemes resistentes (impermeabilidad)+β-lactamasa de espectro extendido
(BLEE) + Clavulánico Inhibido y 8 (6,83 %) Resistencia de alto nivel+ Resistencia
a Tícarcilina no enzimática de bajo nivel.
Para los aminoglucósido 50 (42,73 %) cepas mostraron fenotipos resistentes;
(GEN, NET, AMI, TOB) (GEN NET AMI); 45 (38,46 %) salvajes y 15 (12,82 %) resistentes
(TOB, NET, AMI). Para Quinolonas 66 (56,41 %) se comportaron con fenotipos resistentes.
Para Tetraciclina y Polipéptidos la mayoría de los fenotipos fueron
salvajes con 116 (99,14 %), 91 (77,77) cepas respectivamente (tabla
1).
En la tabla
2 mostramos la comparación de las pruebas de susceptibilidad de los
porcientos de resistencia entre los servicios hospitalarios y las unidades de
atención al grave hubo un aumento de la misma en Ceftazidima 60,60 %; Cefepime
56,06 %; Aztreonam 68,18 %; Imipenem 43,93 %, Meropenem 45,45 %; Amikacina 54,54
%; Gentamicina 42,42 % y Ciprofloxacina 59,09 % con respecto a los otros servicios
del hospital.
DISCUSIÓN
La Pseudomonas aeruginosa representa dentro del grupo de bacilos gram negativos no fermentadores de glucosa uno de los patógenos más importantes asociados a sepsis graves.9 Estudios realizados por países europeos como España, realizados a más de 10 000 pacientes ingresados en 112 UCI (Unidades de Cuidados Intensivos), destacó a esta especie microbiana como la más frecuente aislada de muestras clínicas.10 Jimeno A y cols. reportaron, además, en el año 2011 un brote de infecciones por Pseudomonas aeruginosa solamente en las unidades de cuidados al paciente crítico.11
De todas las infecciones en pacientes críticos donde se asocia la Pseudomonas aeruginosa a, las neumonías asociadas a la ventilación y las bacteriemias, son las más frecuentes, de ahí que las muestras más útiles para detectar las infecciones por este bacilo sea el cultivo del aspirado traqueal y el hemocultivo.12,13 En la fig. 2 se observa como en un 38 y 25 % de las cepas aisladas se correspondieron con estas muestras, esto no es un hecho aislado. La significación clínica de aislamientos de este microorganismo en muestras de secreciones endotraqueales se debe a que este se presenta según lo reportado recientemente tanto por la literatura médica local,14 como la internacional,15,16 como uno de los principales agentes etiológicos de NAVM. Investigaciones realizadas sobre la adherencia bacteriana por Niederman y cols.17 sugieren un tropismo especial de este microorganismo hacia el epitelio traqueal lo que explica la alta prevalencia de Pseudomonas aeruginosa en las muestras de secreciones endotraqueales. Otro de los factores que puede incidir es la colonización en pacientes ventilados, esta se relaciona con la inoculación directa a través de la manipulación de la vía respiratoria artificial o de los equipos de terapia respiratoria por parte del personal sanitario y siempre antecede a la infección.18
Pseudomonas aeruginosa es un microorganismo oportunista frecuentemente implicado en infecciones de origen nosocomial que presenta resistencia natural y adquirida por múltiples mecanismos a muchos de los antimicrobianos de uso clínico.19 En estudio realizado en Lima, Perú, se reportó que los antibióticos con mayor porcentaje de resistencia fueron: Ceftazidima con (71 %), Aztreonam (62 %), Ciprofloxacina (57 %) y Gentamicina (55 %). Resultados similares fueron encontrados en nuestro estudio, mientras que en ese estudio el meropenem fue el antibiótico de mejor actividad con solo un 27 %20 de resistencia, no siendo así en nuestro trabajo, con un 41,08 % de resistencia y obteniendo mejores resultados para el Imipenem con un 33,33 %. En Brasil, en el estado de Rio de Janeiro, muestras colectadas en 5 hospitales manifestaron incrementos en la resistencia por encima del 40 %.21 Los carbapenémicos han sido los antibióticos β-lactámicos de mayor actividad evadiendo la mayoría de los mecanismos de resistencia bacteriana y, generalmente, se reservan para el tratamiento de infecciones graves o para aquellas causadas por organismos resistentes a los otros antibióticos.22 Por otra parte en un estudio realizado en México encontraron un 13 % de resistencia a colistina,23 datos similares a los encontrados en nuestro trabajo.
En conclusión, las cepas analizadas mostraron niveles de resistencia muy elevados para todos los antibióticos probados yse destacó el incremento de la misma frente a Meropenem, Imipenem y Colistina. Dentro de los fenotipos de resistencia detectados contra la familia de β-lactámicos se destacó: Resistencia de alto nivel+ Carbapenemes Resistentes (impermeabilidad), para los aminoglucósidos (GEN, NET, AMI, TOB) (GEN NET AMI), las Quinolonas se comportaron con fenotipos resistentes, mientras que para Tetraciclina y Polipéptidos la mayoría de los fenotipos fueron salvajes.
REFERENCIAS BIBLIOGRÁFICAS
1. Llop Hernadez A, Valdes-Dapena Vivanco MM, Zuazo Silva JL Microbiologia y Parasitologia Medicas. La Habana: Editorial Ciencias Médicas; 2001.
2. Driscoll JA, Brody SL, Kollef MH. Epidemiología, mecanismos de infección, virulencia, resistencia y tratamiento de las infecciones por P. aeruginosa. Drugs. 2007;67(3):351-68.
3. Vila J, Francesc M. Lectura interpretada del antibiograma de bacilos gramnegativos no fermentadores. Enferm Infecc Microbiol Clin. 2002;20(6):304-12.
4. De Freitas A, Barth A. Antibiotic resistance and molecular typing of Pseudomonas aeruginosa: focus on imipenem. Braz J Infect Dis. 2002;6(1):1-7.
5. Okeke IN, Klugman KP, Bhutta ZA, Duse AG, Jenkins P, O'Brien TF, et al. Antimicrobial resistance in developing countries. Part II: strategies for containment. Lancet Infect Dis. 2005;5(8):481-93.
6. Centros para el Control y la Prevención de Enfermedades 1600 Clifton Rd. Atlanta, GA 30333, USA 800-CDC-INFO (800-232-4636) Línea TTY;(888):232-6348.
7. Manual de Normas y Procedimientos. La Habana: Hospital Cínico Quirúrgico "Hermanos Ameijeiras". 2006 [citado2 0 Dic 2016]. Disponible en: http://www.hha.sld.cu
8. Manual de Procedimientos del VITEK 2 compact. Biomerieux. 2007 [consultado Ene 2012]. Disponible en: http://www.biomerieux.es/servlet/srt/bio/spain/home
9. Montefour K, Frieden J, Hurst S, Helmich C, Headley D, Martin M, et al. Acinetobacter baumannii: an emerging multidrug-resistant pathogen in critical care. Crit Care Nurse. 2008;28:15-25.
10. Alvarez-Lerma F, Palomar M, Olaechea P, Otal JJ, Insausti J, Cerdá E. National study of control of nosocomial infection in intensive care units. Evolutive report of the years 2003-2005. Med Intensiva. 2007;31:6-17.
11. Jimeno A , Alcalde MM , Blázquez A. Detección de un brote epidémico por Pseudomonas aeruginosa multirresistente productora de metalo-beta-lactamasa. Rev Clin Esp. 2011;211(4):187-91.
12. Mercedes H. Infección por bacilos gram-negativos no fermentadores. Problemática en las unidades de cuidados intensivos. Rev Haban Cienc Méd. 2011;9(5):78-82.
13. Olaechea PM, Insausti J, Blanco A, Luque P. Epidemiología e impacto de las infecciones nosocomiales. Med. Intensiva. 2010;34(4):40-51.
14. Castro M, Tartabull K, Nicolau E. Microorganismos aislados en pacientes con infecciones asociadas a la ventilación mecánica en los servicios de atención al grave. Rev Arch Méd Camagüey. 2010;14(4):120-32.
15. Ortiz G, Fonseca N, Molina F, Garay M, Lara A, Dueñas C, et al. Epidemiología de la neumonía asociada a ventilador en 39 unidades de cuidados intensivos de Colombia (2007-2009). Informe año 2010. Acta Colom Cuidado Intens. 2011;11(1):12-9.
16. Díaz E, Lorente L, Valles J, Rello J. Neumonía asociada a la ventilación mecánica. Med. 2010;34:217-34.
17. Niederman MS, Mantovani R, Schock P, Papas J, Fein AM. Patterns and routes of tracheobronchial colonization in mechanically ventilated patients: the role of nutritional status in colonization of the lower airway by Pseudomonas species. Chest. 1989;95(1):155-61.
18. Vallésa J, Mariscal D. Neumonía por Pseudomonas aeruginosa. Enferm Infecc Microbiol Clin. 2005;23(3):30-6.
19. Gamero Delgado MC, García Mayorgas AD, Rodríguez F, Ibarra A, Casal Román M. Rev Esp Quimioterapia. 2007;20(2):230-3.
20. Luján Roca DA, Ibarra Trujillo JO, Mamani Huamán E. Resistencia a los antibióticos en aislados clínicos de Pseudomonas aeruginosae un hospital universitario en Lima, Perú. Rev Biomed. 2008;19(3):156-60.
21. Pellegrino FL, Teixeira LM, Carvalho MG, Aranha NS, Pinto DO, Mello Samprio JL, et al. Ocurrence of a nultidrugresistance. Pseudomonas aeruginosa clone en differenthospitals en Rio de Janeiro, Brazil. J ClinMicrobiol. 2002;40(7):2420-4.
22. Livermore DM. The impact of carbapenemases on antimicrobial development and therapy. Curr Opin Investig Drugs. 2002;3(2):218-24.
23. Sardiñas C, Hernández A, Oropeza R, Olvera C, Poblano M, Franco J. Colistin en el tratamiento de infección por Pseudomonas aeruginosa multidrogorresistente. Rev Asoc Mex Med Crít y Ter Intens. 2010;24(4):173-7.
Recibido: 28 de
agosto de 2017.
Aprobado: 29 de
septiembre de 2017.
Marcia Hart
Casares. Hospital ¨Hermanos Ameijeiras¨. La Habana, Cuba.
Correo electrónico:
labmicro@hha.sld.cu