ARTÍCULO DE REVISIÓN
(Ver orden de las figuras. Revisar) Ichi
Estudio PET/CT con F18-Fluorodesoxiglucosa en oncología: una herramienta eficaz para una indicación responsable
Study of the PET-CT with fludeoxyglucose F 18 in oncology: an effective tool for a responsible indication
Adlin López Díaz, Lissette Mejías
Hospital CQ "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
Introducción:
el estudio de la tomografía por emisión de positrones unida a la tomografía
computada con F18-Fluorodesoxiglucosa se ha develado como el estudio
"estándar de oro" mínimamente invasivo para el diagnóstico, evaluación
y seguimiento de un conjunto amplio de enfermedades oncológicas.
Métodos:
revisión bibliográfica sobre las principales indicaciones, contraindicaciones,
causas de falsos positivos/negativos y de las limitaciones más importantes
que posee el proceder. Se explican ampliamente: la preparación y conducta
que el paciente debe cumplir antes, durante y después del examen para la
realización satisfactoria del mismo; las características de las diferentes
etapas de la adquisición de imágenes, así como las particularidades
dosimétricas generales que cada una de ellas posee y que deben tenerse
en cuenta para garantizar el cumplimiento de los principios de protección
radiológica de la práctica médica. Se abunda en el procesamiento,
cuantificación e interpretación de las imágenes, así como
en la importancia que para este paso reviste el conocimiento de la historia
clínica del paciente, que unido a la experiencia del grupo profesional
multidisciplinario permite garantizar la adecuada evaluación de los cambios
ocurridos a nivel molecular y que son la base de la eficacia diagnóstica
de esta tecnología.
Conclusiones:
el estudio de la tomografía por emisión de positrones unida a
la tomografía computada con F18-Fluorodesoxiglucosa juega un
importante papel en el manejo de la enfermedad oncológica. Es un estudio
eficaz, pero requiere condiciones especiales para la preparación del paciente
y el desarrollo de estudio, así como la integración de un grupo multidisciplinario
de especialistas de alta calificación.
Palabras clave:
tomografía por emisión de positrones unida a la tomografía
computada; F18-Fluorodesoxiglucosa; oncología.
ABSTRACT
Introduction:
The study of the positron emission tomography together with computed tomography
with fludeoxyglucose F 18 has been revealed as the "gold standard" minimally
invasive study for the diagnosis, assessment and follow-up of a wide range of
oncological diseases.
Methods:
Bibliographic review on the main indications, contraindications, causes of false
positives or false negatives and of the most important limitations of the procedure.
We broadly explain the preparation and behavior the patient must complete before,
during and after the examination for its satisfactory performance are widely
explained, the characteristics of the different stages of the acquisition of
images, as well as the general dosimetric characteristics that each of them
possesses and that must be taken into account to ensure compliance with the
principles of radiological protection in the medical practice. We go deeply
into details regarding the processing, quantification and interpretation of
the images, as well as into the importance for this step of knowing the patient's
clinical history, which together with the experience of the multidisciplinary
professional group allows to guarantee the adequate evaluation of the changes
occurring at the molecular level and that are the basis of the diagnostic efficiency
of this technology.
Conclusions:
The study of positron emission tomography together with computed tomography
with fludeoxyglucose F 18 plays an important role in the management of oncological
disease. It is an effective study, but requires special conditions for the preparation
of the patient and the development of the study, as well as the integration
of a multidisciplinary group of highly-qualified specialists.
Keywords:
positron emission tomography with computerized tomography; fludeoxyglucose F
18; oncology.
INTRODUCCIÓN
La tomografía por emisión de positrones (PET) es un método de diagnóstico por imagen que tiene sus principales indicaciones dentro de la oncología, la neurología y la cardiología. Brinda imágenes de la distribución tridimensional en el organismo de radiofármacos marcados con trazadores radiactivos emisores de positrones, los cuales representan procesos bioquímicos in vivo. Como método capaz de obtener imágenes "moleculares o metabólicas", puede detectar precozmente las alteraciones funcionales que preceden a los cambios anatómicos producidos por ciertas enfermedades.1
La PET evalúa parámetros fisiológicos y bioquímicos no accesibles mediante otras técnicas de imagen, produciendo un salto en la exactitud diagnóstica al unir esta fortaleza indiscutible a la tomografía computada (CT) que aporta los detalles anatómicos y estructurales. Este equipo híbrido PET/CT produce una imagen integrada de ambas técnicas capaz de brindar lo mejor de ambas.
En oncología, la PET/CT tiene una importancia vital, pues la caracterización de las lesiones estructurales, que acompañan a la enfermedad tumoral, constituye uno de los avances más importantes en su diagnóstico y seguimiento. En la actualidad, existen varios radio-trazadores positrónicos con los que se pueden determinar algunos de los procesos fisiológicos que caracterizan a los tumores malignos, como el flujo sanguíneo, el metabolismo oxidativo, la actividad glicolítica, el transporte de aminoácidos o la síntesis proteica.2-4
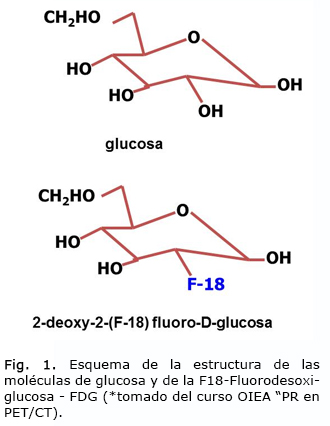
Hasta la fecha, el radiofármaco más utilizado en la tecnología PET ha sido la 2-[18F]-fluoro-2-Deoxi-D-glucosa (FDG), un análogo de la glucosa natural marcada con Flúor-18, radionúclido emisor de positrones con un período de semidesintegración radioactiva de 109 minutos, tiempo en el que la actividad se reduce a la mitad. La figura 1 muestra un esquema de la estructura de la glucosa y de la FDG.
Esta molécula marcada fue obtenida por primera vez en 1978 por el grupo de Wolf y Fowler del Brookhaven National Laboratory (Ido, 1978).5 La primera imagen de PET con FDG fue obtenida por Phelps y cols (Phelps, 1979). Más tarde, Hamacher y cols. del Institut für Nuklearchemie de Jülich en Alemania, desarrollaron un nuevo método de síntesis para la FDG mediante una reacción de sustitución nucleofílica (Hamacher, 1986), que es el método de elección en la actualidad. Su extensión a la práctica clínica intra-hospitalaria, se ha sustentado en la evolución de los mini-ciclotrones" de uso médico (conocidos como baby-cyclotron) y los módulos automatizados de síntesis de radiofármacos PET. El primer mini-ciclotrón de uso médico fue introducido por primera vez en 1984 (el RDS: Radiopharmaceutical Delivery System) y el primer módulo de síntesis química automatizado para FDG y otros trazadores en 1989 (Padgett, 1989).5,6
¿La FDG es un marcador tumoral?
A pesar de que entre el 85-90 % de los usos de la FDG se relacionan con la enfermedad oncológica, este radiofármaco no es un marcador de proliferación de células neoplásicas, sino del metabolismo glucídico que estas poseen.
La FDG al igual que la glucosa atraviesa fácilmente la membrana celular e incluso la barrera hematoencefálica. Tras su entrada en la célula, ambos compuestos inician la vía glicolítica, con la fosforilación en el carbono 6 por la enzima hexoquinasa, que también presenta una mayor actividad en las células tumorales. El siguiente paso de la vía glicolítica es la isomerización por acción de la enzima fosfoglucosa isomerasa para formar fructosa-6-fosfato. Puesto que tanto la glucosa-6-fosfato como la fructosa-6-fosfato existen predominantemente en su forma cíclica, la reacción requiere la apertura del anillo, seguidamente la isomerización y finalmente el cierre del nuevo anillo de furanosa formado. La intervención del grupo hidroxilo en C2 es fundamental para que pueda llevarse a cabo la isomerización, por lo que la FDG-6-P no es un sustrato adecuado para la fosfoglucosa isomerasa, y por ello la FDG sufre atrapamiento metabólico en la célula. La conversión a FDG-6-P impide su difusión atravesando la membrana celular, por lo que el resultado final es el acúmulo progresivo del derivado fluorizado en el interior de la célula ávida de glucosa.7
El uso de la FDG en oncología se basa precisamente en el mayor consumo de glucosa que presentan los tejidos tumorales, pues la degradación de la glucosa tiene lugar mediante una vía anaeróbica, en la que el rendimiento energético es de únicamente 2 moléculas de ATP por molécula de glucosa, mientras que en la oxidación aeróbica se obtienen 38 ATP. Se presume que la célula tumoral prefiere el metabolismo anaeróbico por la velocidad significativamente superior de la fermentación frente al catabolismo oxidativo (casi 100 veces mayor). Por ello, siempre que el aporte del sustrato energético sea suficiente, la célula tumoral en crecimiento compensa el menor rendimiento energético del proceso anaeróbico con su mayor velocidad, de modo que el consumo de glucosa es muy elevado. La mayor incorporación de FDG al interior de la célula neoplásica se ve favorecida, además, por el aumento en la expresión de los transportadores de membrana (GLUT), secundario a la activación de genes que los codifican.4,8
La acumulación de la FDG en el tumor se ve afectada, entre otros factores, por el flujo sanguíneo tumoral, la actividad de los transportadores de glucosa y hexoquinasa, y por el consumo celular propio de glucosa, por eso la captación de todos los tumores no es la misma y las imágenes deben ser analizadas con cuidado por médicos especialistas bien entrenados que puedan reconocer los patrones variados que se presentan, sobre todo porque otros tejidos como la grasa parda, los músculos, cerebro, etc. pueden presentar captación3,4,7,9 (fig. 2). Esta característica de la FDG obliga a una preparación y monitoreo estricto del paciente a fin de evitar falsos positivos por este concepto, pues a pesar de que la incorporación en tejidos inflamados es inferior a la de las lesiones neoplásicas malignas, se han descrito casos de falsos positivos en inflamaciones, infecciones y granulomas, por tanto el valor predictivo positivo de la PET es inferior al negativo.9,10
¿Qué utilidad posee la FDG en oncología?
Atendiendo al comportamiento de la FDG y las características en el metabolismo glicolítico de los tejidos tumorales la PET, mediante el uso de la FDG, se pueden diferenciar lesiones benignas de malignas, estadificar los procesos neoplásicos con un solo estudio, detectar y localizar recurrencias (difíciles de diferenciar en la RM o TAC de procesos cicatriciales post-cirugía o post-radioterapia) así como guiar y monitorizar los efectos de los tratamientos.10,11
La PET posee una baja resolución espacial para detectar las micro-metástasis, sin embargo posee una buena resolución de contraste que si puede demostrar infiltración tumoral en adenopatías de tamaño normal y en órganos que aún no presentan alteraciones anatómicas detectables por CT o RMN.12,13 La posibilidad de rastrear y disponer de imágenes de cuerpo entero incrementa el rendimiento clínico de la PET, que puede definir la extensión real de una enfermedad tumoral multifocal en el mismo acto exploratorio.10
El incremento de la captación de FDG se relaciona con la proliferación celular y con el grado de malignidad, las áreas de necrosis y fibrosis no presentan captación alguna. Los tumores más agresivos son los que suelen presentar mayor captación de FDG, por eso se afirma que no es igualmente eficaz en todos los procesos oncológicos y por eso la literatura médica concerniente a las aplicaciones de la tecnología y de otros radiofármacos continúa en desarrollo e incremento continuos.14-16
Alrededor del 90 % de los estudios PET/CT con FDG en la actualidad tienen indicación oncológica,10 aunque el panorama puede cambiar a mediano plazo con el surgimiento de nuevos radiofármacos y nuevas aplicaciones. Existe evidencia sustancial de la exactitud diagnóstica significativamente superior de esta tecnología híbrida sobre el resto de las técnicas disponibles para determinar el estadio del cáncer (estadificación o estadiamiento), la detección de recurrencia y el seguimiento de los diferentes tratamientos (fig. 3). Un número importante de publicaciones científicas apuntan a que la información brindada por esta técnica puede alterar el manejo previsto de aproximadamente el 30 % de los pacientes.2-4,8-11,17-21 Estos datos se confirman ampliamente en enfermedades oncológicas muy frecuentes como pulmón, mama, cérvix, esófago, cabeza y cuello, colon, linfomas, melanoma, etc.17-20 (La fig. 3 es a, b y c. Cómo hago este enlace?) Ichi
Evaluaciones independientes de las tecnologías de salud (Health Technology Assessments: HTAs) confirman estos reportes clínicos de eficacia. En 2006, comenzó en Estados Unidos de América, un Registro Nacional de estudios oncológicos PET (National Oncologic PET Registry: NOPR) para asegurar el beneficio de los estudios PET en otras indicaciones no aprobadas previamente para re-embolso por el seguro. Este registro analizó 23 000 estudios PET en el primer año, arrojando que el tratamiento del 36 % de los pacientes analizados se estableció como consecuencia directa del estudio, confirmando el valor de la técnica en un grupo mayor de dolencias oncológicas. Estos resultados se reafirmaron en 2008, cuando los exámenes auditados alcanzaron los 75000. Resultados similares se obtuvieron en Australia después de colectar un aproximado de 30 000 exploraciones PET.10,21,22
¿Cuáles son las indicaciones principales de la PET/CT con FDG en oncología?
La PET/CT es una tecnología joven y en franca evolución, las diferencias encontradas en la literatura están enmarcadas en las particularidades de su empleo en los distintos países, por tanto es difícil encontrar un criterio estricto que resuma y concrete todos los resultados reportados. La conclusión general es que la PET/CT con FDG no es igualmente eficaz ni costo-efectiva en todas las etapas de diagnóstico y tratamiento de los diferentes procesos oncológicos, por esta causa las siguientes indicaciones son una combinación de bibliográfica científica y experiencias de expertos, así que deben ser ajustadas a las condiciones específicas, revisadas y actualizadas sistemáticamente.
De forma general se puede resumir que las indicaciones oncológicas principales de la FDG son:23-35
1. Diagnóstico, diferenciación entre lesiones benignas y malignas (en nódulos solitarios, frente a discrepancias entre la clínica y exámenes complementarios indeterminados, aunque el método recomendado es la biopsia).
2. Búsqueda de tumores primarios desconocidos, ante síndromes para-neoplásicos y metástasis.
3. Estadificación de procesos oncológicos conocidos.
4. Monitorización de la terapia oncológica.
5. Diferenciación entre la recurrencia tumoral y los cambios tras el tratamiento, ante exploraciones complementarias indeterminadas.
6. Determinar la recidiva tumoral ante elevación de marcadores tumorales.
7. Selección de la localización de la región tumoral para realizar biopsia.
8. Guía para planificar la radioterapia.
¿Qué debe acompañar una indicación de PET/CT con FDG?
La indicación clínica debe explicar la razón y objetivo de la prueba, el tipo y la localización de la neoplasia, las fechas del diagnóstico y el tratamiento (resultados de las biopsias, cirugía, radioterapia, quimioterapia, administración de estimulantes de la médula ósea y esteroides), así como la medicación actual y si posee estudios PET/CT anteriores. Co-morbilidades asociadas, especialmente si existe inflamación y/infección, la diabetes mellitus y su tratamiento, enfermedades renales, alergias a contrastes imagenológicos, etc.
Esta información es de vital importancia porque existen algunas situaciones clínicas que pueden afectar la captación de FDG que deben tenerse en cuenta a la hora de indicar y autorizar un estudio. Estas situaciones y su recomendación de actuación se recogen en la tabla 1.
¿Posee la FDG alguna contraindicación o precaución asociada?
Las indicaciones de los estudios PET/CT deben ser autorizados por un médico cualificado, que analice la conveniencia y justificación del estudio. De forma general se pueden mencionar como contraindicaciones totales o parciales las siguientes:
¿Qué preparación deberá desarrollar el paciente antes, durante
y después del estudio?
El objetivo principal de la preparación física y psíquica del paciente es minimizar la captación del radiofármaco en los tejidos normales, como el corazón y los músculos, mientras se mantiene la captación en los tejidos neoplásicos. Él deberá ser informado de las diferentes etapas del procedimiento y la importancia de cada una para su éxito. La información deberá ajustarse a las características del departamento y a la situación concreta del paciente, favoreciendo el desarrollo del estudio, evitando la irradiación innecesaria del personal y la repetición injustificada de exámenes.25,27,32-35
Usualmente el paciente recibirá instrucciones de:
La administración del radiofármaco debe realizarse, a través
de la vena previamente canalizada, con dosis entre 2 y 10 MBq/kg, según
el tipo de instrumento empleado para la tomografía PET, pues los equipos
más modernos han permitido una reducción considerable de la actividad
a administrar. En niños, se aplicará generalmente para estudios cuerpo
completo actividades entre 3,7-5,2 MBq/Kg, para estudios de cerebro 3,7 MBq/Kg,
con un mínimo de 3,7 MBq.
El paciente debe estar recostado cómodamente; con temperatura, iluminación y ambiente confortable para él, de esa forma se evitará la captación muscular y se facilitará el reposo sensorial y motor. Este estatus deberá mantenerse unos minutos antes de la administración y durante toda la fase de incorporación del trazador hasta la adquisición del estudio, que puede tardar para una distribución óptima de FDG 60min, aunque en algunos servicios estos tiempos se modifican de acuerdo a la dolencia y el interés del estudio.
El cumplimiento de cada una de estas etapas es de vital importancia para garantizar la calidad y fiabilidad del estudio. La figura 4 muestra la pérdida de calidad diagnóstica de un estudio por mala preparación y falta de reposo del paciente.
¿Qué características posee la adquisición de las imágenes?
Como ya se conoce, la imagen híbrida PET/CT es el resultado del co-registro de las imágenes de ambas tecnologías, en la cual las imágenes PET se corrigen y mejoran significativamente utilizando la información morfológica que aportan las imágenes de CT. La forma en que se desarrolla este procesamiento varía significativamente entre fabricantes y con la etapa o generación de desarrollo del equipamiento.
En general, la primera fase es conocida como topograma, donde se obtiene una imagen con el tubo de rayos X fijo en una posición, que suele ser anterior, aunque también puede ser posterior, lateral o en una orientación intermedia si la enfermedad así lo requiere. Esta adquisición se realiza con un movimiento continuo de la camilla, y su objetivo es obtener una imagen anatómica de referencia en la que se aprecien las distintas estructuras de interés y poder definir en ella los límites del estudio PET/CT combinado. Una vez determinados los límites de la exploración, se ajustarán los campos de adquisición de ambas técnicas.
Usualmente el volumen a precisar en el topograma depende del objetivo del examen y de la región a diagnosticar. Para los estudios de cuerpo completo se recomienda la adquisición comprendida entre la base del cráneo y el tercio proximal del muslo. Para los tumores que tienen afinidad por el cuero cabelludo, calota o cerebro, se debe estudiar estas regiones. Pueden ser necesarias imágenes adicionales para la valoración regional de la localización tumoral, para evitar los movimientos del paciente en posiciones incómodas, por el uso de inmovilizadores, etc. La duración total de esta etapa dependiente de la generación y tipo de equipo, aunque en la actualidad no supera los 3 minutos toda la secuencia.
Se procede entonces a la segunda etapa del examen que es la adquisición de las imágenes de tomografía computada (CT). Esta secuencia de imágenes puede tener varios objetivos, aunque los más importantes son permitir la corrección de atenuación y facilitar la localización precisa de las lesiones hipermetabólicas. Además puede tener una finalidad diagnóstica o para tratamiento radiante. Si el CT es sólo para corrección de atenuación y localización de las lesiones, se realiza un protocolo rápido, de baja tasa de dosis. La duración de la adquisición de CT depende de varios parámetros: extensión de la zona explorada, número de cortes del equipo, velocidad de rotación del tubo y de traslación de la camilla (para un estudio de cuerpo entero, la duración suele ser menor de 1 min). Si las necesidades de la tomografía exigen administración de contraste, estas deberán realizarse después de la imagen PET, en una cuarta etapa, para evitar la posible influencia en la cuantificación de la imagen PET.
Una vez adquirido el mapa de atenuación, la camilla se ubica en el campo de visión PET y se procede a adquirir la secuencia de estas imágenes, siempre en modo parada-disparo (step and shoot), usualmente comenzando de las piernas hacia arriba para evitar el llenado de la vejiga. Es importante la respiración lenta y acompasada del paciente durante todo el estudio, para evitar artefactos inducidos por la respiración en el co-registro. La duración de cada volumen y del estudio total es muy dependiente del equipo y sus características, el modo de adquisición 2D o 3D, la actividad administrada, el peso del paciente, etc. usualmente oscila entre 15 y 35 min.25,27,32-35
¿Cómo se procesan las imágenes?
La reconstrucción PET utiliza los datos de la emisión de fotones coincidentes provenientes del paciente, conformada por los eventos registrados en las líneas de respuesta entre estos pares de fotones. Los datos de emisión se corrigen básicamente por la eficiencia de cada detector (proceso denominado normalización), el tiempo muerto del sistema, las coincidencias aleatorias, la atenuación y la dispersión (scatter) que produce el paciente y que son determinadas a partir de las imágenes del CT, etc. Actualmente, la reconstrucción iterativa prácticamente ha reemplazado a la retroproyección filtrada, pues emplea mecanismos más eficientes para corregir varios de los fenómenos físicos implicados en la obtención de la imagen. Los parámetros apropiados de reconstrucción dependen del modo de adquisición, del tipo del equipo y de las funciones que tendrá la imagen.32-39
Generalmente, los sinogramas CT se reconstruyen por retroproyección filtrada de cuerpo completo y estos datos se usan para la corrección de atenuación de los datos de la emisión de la PET. Para la interpretación del CT se requiere la aplicación de un zoom apropiado, grosor de corte y solapamiento, así como la modificación de algoritmos de reconstrucción de las diferentes regiones del estudio. De forma sistemática, se utilizan también algoritmos de segmentación automáticos o semiautomáticos órgano-específicos. Se recomienda archivar las reconstrucciones, con y sin atenuación, para resolver artefactos que puedan derivarse de la aplicación de la corrección de atenuación.36-39
La forma en que se presentan las imágenes es variable, aunque generalmente los paquetes de software proporcionan imágenes de CT registradas o alineadas. Las imágenes en tres cortes de la PET con 18F-FDG, las imágenes volumétricas en modo cine 3D y las imágenes de fusión en los tres planos.25,27,32-39
A partir de las imágenes tomográficas obtenidas con la PET, es posible realizar medidas cuantitativas de la concentración del radiofármaco en el interior del organismo. En oncología, puede ser muy útil cuantificar la captación de FDG en las lesiones tumorales, sobre todo para efectuar comparaciones evolutivas o post-terapia (fig. 3).
Para realizar una cuantificación absoluta del consumo tumoral de glucosa
se requiere una metodología muy meticulosa, por eso en la práctica
clínica se realiza una cuantificación relativa. Como índice de
captación se emplea generalmente el índice estandarizado
de captación,2,3,23-26 conocido como SUV: Standard uptake
value, que es la captación de la lesión dividida por la dosis de trazador
administrada corregida por el peso corporal:
Sin embargo, este valor debe ser manejado con cautela, pues además de los
factores relacionados con el tumor y la preparación del paciente, depende
de otros aspectos técnicos como son el tiempo post-administración,
el método de adquisición y de reconstrucción, el trazado de las
regiones de interés, etc.24-26,28,33,34
¿Cómo se interpretan las imágenes?
Primeramente se realiza una valoración visual, teniendo en cuenta la distribución fisiológica de la FDG y las variantes de la normalidad. Este radiofármaco se observa normalmente en diferente cuantía en cerebro, miocardio, mama, hígado, bazo, estómago, intestino, riñones y vejiga, músculo, tejido linfoide, médula ósea, glándulas salivales, timo, útero, ovarios, testículos y grasa parda (fig. 2: imágenes de la captación normal de FDG).
Se puede observar también FDG en el tejido de granulación (heridas), las infecciones y otros procesos inflamatorios (fig. 5).
Usualmente se considera como lesión todo aumento de la captación de FDG en relación con el tejido circundante o región homóloga que no se corresponda además con la captación fisiológica (fig. 2: captación normal y fig. 3: captaciones patológicas). Sin embargo, la identificación de una lesión no presupone obligatoriamente un proceso oncológico, sino que la interpretación del experto debe basarse en el contexto clínico concreto, tener en cuenta los hallazgos específicos del CT, la correlación con la historia clínica, el examen físico y otras técnicas de imagen, etc. (figs. 4, 5 y 6). Este proceso de análisis requiere de una alta preparación del equipo de especialistas y es de vital importancia para la eficacia diagnóstica.25,27,32-35
¿Cuáles son las causas más frecuentes de fallos diagnósticos?
Como se ha mencionado anteriormente, otros procesos y circunstancias pueden afectar o modificar la captación de FDG por los tejidos, ocasionando falsos positivos o falsos negativos.18-22,25-27,33-39
En la tabla 2 se incluyen las causas más comunes de errores, aunque pudieran existir otras no mencionadas en este documento.
Esta tabla evidencia la importancia de un conocimiento amplio del paciente, de las indicaciones clínicas de la prueba, de la preparación correcta para su desarrollo, etc., para evitar exámenes innecesarios o erróneos.
¿Qué debe esperar un especialista en un informe de estudio PET/CT?
Un informe de estudio PET/CT generalmente consta de tres partes principales, la primera recoge la identificación del procedimiento, los detalles concretos de la información clínica del paciente (indicación del estudio y algún dato clínico relevante), la descripción del procedimiento completo incluyendo toda la información del radiofármaco, medicación, tiempos de espera, técnica de adquisición y procesamiento de imágenes, etc.
Una segunda etapa que incluye la descripción de los hallazgos del estudio y que se pueden resumir como:
- Descripción de la extensión y la intensidad de la captación de 18F-FDG (en relación con la captación de los tejidos normales), valorando su correcta localización y los hallazgos morfológicos relevantes en el estudio CT y en las imágenes de fusión. La estimación de la intensidad de la captación de la FDG puede ser proporcionada por el SUV, pero a los efectos prácticos esta puede describirse como leve, moderada o intensa en relación con una captación de fondo. Los informes integrados PET-CT deben incluir todos los hallazgos incidentales de las imágenes de CT que son relevantes para el cuidado de los pacientes.
- En esta parte deben reflejarse también aspectos relacionados con la calidad del estudio como la limitación por movimientos, captación muscular o hiperglucemia, etc.
- Se deberá identificar los factores que limitan la sensibilidad y la especificidad de la prueba (lesiones pequeñas o procesos inflamatorios).
- Si la prueba tenía un objetivo concreto el informe debe reflejar las respuestas a las preguntas clínicas pertinentes.
- Los resultados deberán compararse con el resto de las exploraciones complementarias. Si el estudio PET/CT se realiza para monitorizar la terapia, se debe comparar la extensión y la intensidad de la captación con los estudios previos.
La tercera parte incluye la impresión o conclusiones diagnósticas.
Siempre que sea posible debe ser claro y brindar un diagnóstico preciso,
realizar un diagnóstico diferencial y/o si se considera apropiado debe
indicar un seguimiento o una exploración complementaria para confirmar
la impresión clínica.
¿Qué dosis de radiación puede recibirse por un examen de PET/CT
con FDG? ¿Tiene algún riesgo para la salud?
El uso de cualquier técnica que emplea radiaciones ionizantes producirá en el paciente una dosis de radiación que debe valorarse concienzudamente a la hora de indicar y justificar un examen. El incremento considerable del número procedimientos diagnósticos y terapéuticos actuales que emplean radiaciones; así como la elevación de la escala de dosis de los mismos, es un aspecto que no debe descuidarse. La dosis efectiva producida por algunos exámenes muy frecuentes de CT, de Medicina Nuclear, de fluoroscopía o de intervencionismo equivale a la producida por más de cien radiografías convencionales de la misma área, aunque este lejos de provocar efectos dañinos directamente inducidos por la radiación33,40,41 siempre que se conserven las normas de radioprotección.
En el caso del PET/CT hay que considerar las dosis producidas por ambos exámenes, e incluso tener en cuenta cuál es su objetivo para puntualizar la técnica de CT que se empleará y que definirá la posible dosis total.
Estimar la dosis producida por el estudio PET es menos complejo que estimar la dosis producida por el CT. En un estudio PET la dosis efectiva recibida por la administración de un radiofármaco depende básicamente de la actividad administrada al paciente y de su biocinética. Es decir los parámetros de la exploración o la realización de múltiples adquisiciones en el tiempo, no afectan la dosis de radiación que el paciente recibe por la técnica PET.
Estudios de biodistribución y farmacocinética realizados en sujetos normales han permitido conocer que la dosis efectiva por unidad de actividad administrada de FDG es 1,9 × 10-2 mSv/MBq 40 (ver en la tabla 3 la distribución de dosis típica por órgano). Para disminuir los costos y ganar eficiencia, la tecnología PET ha evolucionado hacia equipos que requieran menor cantidad de actividad de este radiofármaco para producir imágenes de calidad muy similar.33,36-39,42-44 La literatura muestra dosis efectivas promedio que oscilan entre 5,7-7 mSv, abogando por dosis calculadas optimizadas utilizando el peso del paciente y una hidratación adecuada.
En el caso del CT la dosis producida en el paciente está definida por factores
de alta complejidad, dentro de los cuáles son decisivos las características
del equipo, el procedimiento desarrollado y la zona del paciente que se examina.45
Según el estudio de Camacho y cols. en 2011, la contribución
del CT a la dosis efectiva total del examen híbrido en España es muy
variada (desde el 2,1 hasta el 93 %), dependiendo del modo adquisición
de la imagen y su propósito.41,46 Usualmente para un estudio
clásico de PET/CT, el protocolo utilizado se limita a facilitar la corrección
de atenuación o la localización anatómica, de manera que la imagen
de CT se produce con una combinación reducida de la corriente del tubo
(mA), el kilo-voltaje (kVp) óptimo y el tiempo de exposición (s),
que usualmente provoca una dosis efectiva entre 1-4mSv. Sin embargo, adquirir
un CT diagnóstico supone aumentar hasta 4,3 veces la dosis respecto a la
variante clásica,46,47 pues los procedimientos estándar
en un equipo CT multicorte pueden producir dosis efectivas entre 3-19 mSv.48
Esto indica que la dosis efectiva de estudios PET/CT sin CT diagnóstico
oscilan entre 5-15 mSv, mientras que la introducción del CT la eleva entre
20-30mSv.
Estos niveles de dosis son altos si se le compara con los estudios de radiografía convencional clásicos, sin embargo, el aporte que esta técnica diagnóstica posee, justifica con creces la exposición médica del paciente, siempre que se realice de forma correcta y optimizada.
CONCLUSIONES
El estudio PET/CT con FDG juega un importante papel en el manejo de la enfermedad oncológica. Es un estudio eficaz, pero requiere condiciones especiales para la preparación del paciente y el desarrollo de estudio, así como la integración de un grupo multidisciplinario de especialistas de alta calificación. Como cualquier examen diagnóstico tiene causas de falsos negativos y positivos, por lo que exige un manejo de la historia clínica del paciente y un conocimiento de las características de este estudio por parte de galeno que indica el examen. Se debe tener en cuenta el impacto dosimétrico de la adquisición del CT diagnóstico y optimizar los protocolos teniendo en cuenta los diferentes escenarios clínicos. Es una tecnología de alta complejidad que debe utilizarse de forma consciente y organizada para garantizar su éxito en todos los sentidos.
REFERENCIAS BIBLIOGRÁFICAS
1. Miguel Cantero. Tomografía por emisión de positrones: aspectos técnicos. Radiobiología. 2003 [consultado 30 Ene 2014];3:47-58. Disponible en: http://www.rayos.medicina.uma.es/rmf/radiobiologia/revista/radiobiologia.htm
2. Ronald Boellaard, O'Doherty Mike J, Weber Wolfgang A, Mottaghy Felix M, Markus Lonsdale N, Stroobants Sigrid G, et al. GUIDELINES FDG PET and PET/CT: EANM procedure guidelines for tumour PET imaging: version 1.0 . Eur J Nucl Med Mol Imaging. 2010;37:181-200. DOI 10.1007/s00259-009-1297-4.
3. Fletcher JW, Djulbegovic B, Soares HP, Siegel BA, Lowe VJ, Lyman GH, et al. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 2008;49(3):480-508.
4. IAEA (International Atomic Energy Agency). Appropriate Use of FDG-PET for the Management of Cancer Patients. IAEA Human Health Series. No. 9. International Atomic Energy Agency. Viena: International Atomic Energy Agency; 2010.
5. Nutt R. The history of positron emisión tomography. Mol Imag Biol. 2002;4(1):11-26.
6. Peñuelas I. Radiofármacos PET. Rev Esp Med Nuclear, 20:477-98;2001.
7. Gallagher BM, Fowler JS, Gutterson NI, MacGregor RR, Wan CN, Wolf AP, et al. Metabolic trapping as a principle of radiopharmaceutical design: some factors responsible for the biodistribution of [18F] 2-deoxy-2-fluoro-D-glucose. J Nucl Med. 1978;19:1154-61.
8. IAEA-TECDOC-1603 "The Role of PET/CT in Radiation Treatment Planning for Cancer Patient Treatment". Viena: International Atomic Energy Agency; 2008.
9. Schoder H, Larson SM, Yeung HW. PET/CT in oncology: integration into clinical management of lymphoma, melanoma, and gastrointestinal malignancies. J Nucl Med. 2004;45(Suppl 1):72S-81S.
10. Dondi M, Diana Páez D, Zaknun J, Kashyap R, Bischof Delaloye S, Graham S. A guide for clinicians: PET/CT. AIEA, Medical Imaging for the 21st Century. Viena, Austria; 2010 [consultado 30 Ene 2014]. Disponible en: http://www.iaea.org
11. Martí-Climent JM, García MJ, Serra P, Boan JF, Richter JA. Tomografía por emisión de positrones con un equipo PET/TC. Rev Esp Med Nucl. 2005;24:60-79.
12. Townsend DW, Carney JPJ, Yap JT, Hall HC. PET/CT Today and Tomorrow. J Nucl Med. 2004;45(Suppl):4S-14S.
13. IAEA Human Health Series "Quality Assurance for PET and PET/CT Systems". Viena: International Atomic Energy Agency; 2009.
14. Buchmann I, Henze M, Engelbrecht S, Eisenhut M, Runz A, Schäfer M, et al. Comparison of 68Ga-DOTATOC PET and 111In-DTPAOC (Octreoscan) SPECT in patients with neuroendocrine tumours. Eur J Nucl Med Mol Imaging. 2007;34(10):1617-26.
15. Cristina Nanni, Costantino Erran, Luca Boriani, Lorenzo Fantini, Valentina Ambrosini, Stefano Boschi, et ali. 68Ga-Citrate PET/CT for Evaluating Patients with Infections of the Bone: Preliminary Results. J Nucl Med. 2010;51(12):1932-36.
16. Andrei Iagaru, Erik Mittra, David Dick W, Sanjiv Sam Gambhir. Prospective Evaluation of 99mTc MDP Scintigraphy, 18F NaF PET/CT, and 18F FDG PET/CT for Detection of Skeletal Metastases. Mol Imaging Biol. 2012;14:252-9.
17. Czernin J, Allen-Auerbach M, Schelbert HR. Improvements in cancer staging with PET/CT: literature-based evidence as of September 2006. J Nucl Med. 2007;48(Suppl 1):78S-88S.
18. Fletcher JW, Djulbegovic B, Soares HP, Siegel BA, Lowe VJ, Lyman GH, Coleman RE, Wahl R, Paschold JC, Avril N, Einhorn LH, Suh WW, Samson D, Delbeke D, Gorman M, Shields AF. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 2008;49(3):480-508.
19. K Facey, Bradbury I, Laking G, Payne E. Overview of the clinical effectiveness of positron emission tomography imaging in selected cancers. Health Technology Assessment. 2007;11(44):iii-iv-xi-267.
20. Cleemput I, Dargent G, Poelmans J, Camberlin C, Van den Bruel A, Ramaekers D. HTA positron emission tomography imaging in Belgium. Brussels: Belgian Health Care Knowledge Centre (KCE); 2005.
21. Hillner BE, Siegel BA, Liu D, Shields AF, Gareen IF, Hanna L, et al. Impact of positron emission tomography/computed tomography and positron emission tomography (PET) alone on expected management of patients with cancer: initial results from the National Oncologic PET Registry. J Clin Oncol. 2008;26(13):2155-61.
22. Podoloff DA, Advani RH, Allred C, Benson AB, Brown E, Burstein HJ, Carlson RW, et al. NCCN task force report: positron emission tomography (PET)/computed tomography (CT) scanning in cancer. J Natl Compr Canc Netw. 2007;5(Suppl 1):S1-S22.
23. Thie JA. Understanding the standardized uptake value, its methods, and implications for usage. J Nucl Med. 2004;45:1431-34.
24. Dennis Vriens, Eric Visser P, Lioe-Fee de Geus-Oei, Wim Oyen JG. Methodological considerations in quantification of oncological FDG PET studies. Eur J Nucl Med Mol Imaging. 2010;37:1408-25.
25. Blodgett TM, McCook BM, Federle MP. Positron emission tomography/computed tomography: protocol issues and options. Sem Nucl Med. 2006;36:157-68.
26. Manning K, Tepfer B, Goldklang G, Loyd R, Garimella P, Halkar R. Clinical practice guidelines for the utilization of positron emission tomography/computed tomography imaging in selected oncologic applications: suggestions from a Provider Group. Mol Imaging Biol. 2007;9:324-32.
27. García Garzón JR, Rodríguez A, Cabrera A. Tomografía por emisión de positrones de cuerpo completo (PET/CT) con 18F-fluorodesoxiglucosa. Rev Esp Med Nucl. 2009;28(2):85-89.
28. MUFACE. GUÍA PET-TC Protocolo de Prescripción. Mutualidad General de Funcionarios Civiles del Estado. Madrid; 2011 [citado 30 Ene 2014]. Disponible en: http://www.muface.es
29. Mac Manus M, Nestle U, Rosenzweig KE, Carrio I, Messa C, Belohlavek O, et al. Use of PET and PET/CT for Radiation Therapy Planning: IAEA expert report 2006-2007. Radiotherapy and Oncology. 2009;91:85-94.
30. NCCN. Non-Hodgkin's Lymphomas Clinical Practice Guidelines in Oncology Clinical Practice Guidelines in Oncology TM. Journal of National Comprehensive Cancer Network. 2010;8(3):288-334.
31. Kwee TC, Kwee RM, Nievelstein RA. Imaging in staging of malignant lymphoma: a systematic review. Blood. 2008;111:504-16.
32. Pennant M, Takwoingi Y, Pennant L, Davenport C, Fry-Smith A, Eisinga A, et al. A systematic review of positron emission tomography (PET) and positron emission tomography/computed tomography (PET/CT) for the diagnosis of breast cancer recurrence. Health Technol Assess. 2010;14(50):1-103.
33. IAEA Human Health Series No. 26. Standard Operating Procedures for PET/CT: A Practical Approach for Use in Adult Oncology. Vienna: IAEA; 2013.
34. Boellaard R, O'Doherty MJ, Weber WA, Mottaghy FM, Lonsdale MN, Stroobants SG, et al. GUIDELINES: FDG PET and PET/CT: EANM procedure guidelines for tumour PET imaging: version 1.0. Eur J Nucl Med Mol Imaging. 2010;37:181-200. DOI 10.1007/s00259-009-1297-4.
35. Waxman AD, Herholz K, Lewis DH, Herscovitch P, Minoshima S, Ichise M, et al. Society of Nuclear Medicine Procedure Guideline for FDG PET Brain Imaging. 2009 [cited 2014 Jan 30]. Available from: Procedure Guideline for FDG-PET Brain Imaging v1.0
36. GEMINI™ The world's first and only OPEN PET/CT. Philips Medical. 2004 [consultado 8 Sep 2014]. Disponible en: http://www.medical.philips.com
37. Sopena R, Martí-Bonmatí L. Técnicas de imagen multimodalidad. Todo Hospital. 2009;255:190-6.
38. Medical Imaging PET/CT. Siemens. 2014 [consultado 13 Ago 2014]. Disponible en: http://www.healthcare.siemens.com
39. Discovery PET/CT 710. GE Healthcare. 2017 [consultado 30 Jul 2014]. Disponible en: http://www.gehealthcare.com/
40. Curso de Protección Radiológica en PET/CT. OIEA; 2008 [citado 8 Sep 2014]. Disponible en: https://rpop.iaea.org/RPOP/RPoP/Content/AdditionalResources/Training/1_TrainingMaterial/PETCT.htm
41. IAEA Safety Report Series No. 58. Radiation Protection in newer medical imaging techniques PET/CT. Viena: IAEA; 2008.
42. Calzado A, Geleijns J. Tomografía computarizada. Evolución, principios técnicos y aplicaciones. Rev Fis Med. 2010;11(3):163-80.
43. National Electrical Manufacturers Association (2007). NEMA Standard Publication NU2-2007. Performance measurements of positron emission tomographs. National Electrical Manufacturers Association, Rosslyn; 2007.
44. Surti S, Kuhn A, Werner ME, Perkins AE, Kolthammer J, Karp JS, et al. Performance of Philips Gemini TF PET-CT scanner with special consideration for its time- of-flight imaging capabilities. J Nucl Med. 2007;48(3):471-80.
45. Patton JA, Townsend DW, Hutton BF. Hybrid Imaging Technology: From Dreams and Vision to Clinical Devices. Semin Nucl Med. 2009;39:247-63.
46. Camacho C, Martí JF, Falgás M, Vercher JL. Dosis efectivas asociadas a las exploraciones multimodales habituales en medicina nuclear. Rev Esp Med Nucl. 2011;8:268-78.
47. Brix G, Lechel U, Glatting G, Ziegler SI, Münzing W, Müller SP, et al. Radiation exposure of patients undergoing whole-body dual modality 18F-FDG PET/CT examinations. J Nucl Med. 2005;46:608-13.
48. Report to the General Assembly 2008 with scientific annexes. Sources and effects of ionizing radiation. New York: United Nation Scientific Committee on the Effects of Atomic Radiation; 2010.
Recibido: 28 de
agosto de 2017.
Aprobado: 30 de
octubre de 2017.
Adlin López
Díaz. Hospital Clínico Quirúrgico "Hermanos Ameijeiras".
La Habana, Cuba.
Correo electrónico:
jmn@infomed.sld.cu