REVISIÓN BIBLIOGRÁFICA
Papel de la gammagrafía en el diagnóstico de la gastroparesia diabética
Role of scintigraphy in the diagnosis of diabetic gastroparesis
Dr. Léster Rodríguez Paleo, MSc. Adlin López Díaz, Lic. Aley Palau San Pedro, Lic. Juan Miguel Martín Escuela
Hospital Clínico Quirúrgico "Hermanos Ameijeiras". La Habana, Cuba.
RESUMEN
La gastroparesia diabética se define como un retardo en el vaciamiento gástrico, asociada a mal control glucémico y a menudo forma parte de las complicaciones crónicas de la diabetes. Afecta tanto a diabéticos tipo 1 como tipo 2 de larga evolución, es más frecuente en los primeros. Esta revisión, básicamente es una actualización de esta entidad, que tiene un impacto sobre la evolución y el pronóstico del paciente diabético y que es una complicación frecuentemente pasada por alto por relacionarse sus síntomas con otras afecciones. El aumento de la incidencia actual de la gastroparesia se asocia al incremento de la esperanza de vida de los diabéticos, fundamentalmente tipo 1, que permite asistir a complicaciones a largo plazo antes infrecuentes. Se hizo énfasis en los métodos diagnósticos, especialmente en la gammagrafía, por ser el examen más confiable, exacto, poco invasivo y reproducible para su detección, evaluación y seguimiento.
Palabras clave: diabetes, gastroparesia, vaciamiento gástrico, gammagrafía.
ABSTRACT
Diabetic gatroparesis is defined as delay in gastric emptying, associated with poor glycemic control and it is often part on chronic complications of diabetes. It affects both Type 1 diabetics and long-term evolution type 2 diabetics, but it is more frequent in the first ones. This review is basically an update of this entity, which has an impact on the evolution and the prognosis of the diabetic patient, and is also considered a complication which is frequently underestimated because its symptoms are related to other affections. The increase in the current incidence of gastroparesis is associated to the increase in life expectancy of diabetic patients, mainly Type 1 diabetics, and permits to assist long-term complications which were uncommon before. Emphasis was made on diagnostic methods, especially the scintigraphy, because it is considered the most reliable, accurate, minimally invasive and reproducible exam for detection, evaluation and follow-up.
Key words: diabetes, gastroparesis, gastric emptying, scintigraphy.
INTRODUCCIÓN
La gastroparesia se define como un retardo en el vaciamiento gástrico, asociado a síntomas como náusea y/o vómitos, sensación de plenitud gástrica posprandial, saciedad precoz o dolor epigástrico por más de 3 meses.1,2
Hasta hace algunos años se pensaba que la gastroparesia era una condición rara que afectaba a pacientes con diabetes tipo 1 de larga evolución y que se asociaba a un peor pronóstico, ahora se reconoce que afecta tanto a diabéticos tipo 1 como a los del tipo 2 y que es frecuente, aunque muchas veces no es diagnosticada porque sus síntomas se relacionan con otras entidades.2
La retención gástrica en los diabéticos fue descrita por primera vez por Boas, en el año 1925, más tarde, en 1937, Ferroir en su tesis The Diabetic Stomach presentó hallazgos radiológicos destacando que la respuesta motora del estómago era más débil en los diabéticos: "las contracciones son lentas, poco vigorosas y mueren rápidamente". La primera descripción detallada de la asociación entre un vaciamiento gástrico retardado y la diabetes fue realizada por Rundles en el año 1945, quien reportó que el vaciamiento gástrico de bario fue anormalmente lento en 5 de 35 diabéticos tipo 1 con neuropatía periférica. En 1958, Kassander nombró la condición "gatroparesis diabeticorum" (gastroparesia diabética) y comentó que era más pasada por alto que diagnosticada.3-5
La incidencia de la gastroparesia es de 4,8 % en los diabéticos tipo 1 y de 1 % en los tipo 2; la prevalencia se encuentra entre 30 y 50 % en los pacientes de larga evolución, en dependencia del método diagnóstico empleado.6,7
Existe el consenso de que la gastroparesia se desarrolla como promedio a los 10 años de diagnosticada la enfermedad, es más frecuente en los diabéticos tipo 1 con respecto a los del tipo 2; se ve asociada en algunos pacientes a neuropatía, nefropatía y retinopatía diabéticas, como parte de las complicaciones microvasculares.6-8
Bytzer y otros encontraron un aumento en la prevalencia de la entidad en los diabéticos tipo 2, probablemente asociado a la terapia con incretinas y el incremento de este tipo de diabetes en la población general.9
Si bien es cierto que no hay muertes atribuibles directamente a la gastroparesia, la hipoglucemia secundaria al retardo del vaciamiento gástrico puede ser causa directa de muerte en pacientes que se tratan con terapia hipoglucemiante. Por otro lado, una vez establecida la gastroparesia, la calidad de vida del paciente se deteriora por el trastorno orgánico y por la afectación psicosocial que esta produce.10,11
DESARROLLO
Mecanismos
El vaciamiento gástrico involucra una integración del tono del fundus gástrico y las contracciones fásicas antrales, con la inhibición pilórica y la contractilidad duodenal. Requiere una interacción entre el músculo liso, inervación autonómica extrínseca y entérica y células marcapasos especializadas (células intersticiales de Cajal).11
En la actualidad se reconoce que el vaciado gástrico normal depende de la actividad coordinada del estómago proximal y el distal, el píloro y la primera porción del intestino delgado, es conocido desde 1893 que en estado de ayuno la motilidad gástrica experimenta un patrón cíclico, denominado complejo motor migratriz, el cual consiste en una fase I (latencia) de aproximadamente 40 min, una fase II (contracciones irregulares) de 50 min, y la fase III, de entre 5 y 10 min.11
Las partículas sólidas son vaciadas del estómago al intestino durante la fase III. El estómago proximal inicialmente se relaja para acomodar los alimentos, mientras el antro tritura los alimentos sólidos en partículas menores de 2 mm y empuja el quimo hacia el duodeno en contra de la resistencia pilórica de una manera pulsátil.11,12
El descontrol glucémico, los fármacos reguladores de incretinas, la neuropatía autonómica, la neuropatía entérica, la anormalidad de las células intersticiales de Cajal y factores psicosomáticos pueden resultar en un trastorno motor gástrico.13-15
Síntomas
Los síntomas clásicos observados en los pacientes con gastroparesia ya se han comentado anteriormente, no obstante, hay casos asintomáticos, probablemente como resultado de una disfunción vagal.16,17
El dolor abdominal con poca frecuencia se relaciona con la gastroparesia, sin embargo, en un estudio multicéntrico realizado por la National Institutes of Health consortium on gastroparesis, se notifica que 72 % de los pacientes con gastroparesia refirieron este síntoma, que en 18 % resultó ser un síntoma dominante y que su forma de aparición es variable (inducido por la ingestión, de aparición nocturna o que interfiere con el sueño), en todos los casos se descartó otra causa probable de dolor abdominal.16-19
Diagnóstico
La gastroparesia se diagnostica demostrando un retardo en el vaciamiento gástrico y excluyendo otras posibles causas. En los casos asintomáticos, el término "vaciamiento gástrico retardado" es más apropiado que el de gastroparesia, dejando este último para los sintomáticos.10
Según la mayoría de los autores, el método diagnóstico de elección para esta entidad es la gammagrafía del vaciado gástrico de los sólidos y/o líquidos, considerada la prueba de oro (gold standard). También pueden utilizarse otras técnicas como: (1) Vaciamiento gástrico con marcadores radiopacos. (2) El uso de una cápsula inalámbrica que determina la acidez y la presión durante su paso por el estómago, con una sensibilidad de 82 % y especificidad de 83 %, si se compara con la gammagrafía. (3) Test de aliento con C,13 el cual presenta una sensibilidad de 86 % y especificidad de 80 % en relación con la gammagrafía. (4) Resonancia magnética por imágenes (RMI) y el ultrasonido gástrico, este último solo puede ser utilizado para evaluar el vaciado de los líquidos. Ninguno de estos estudios alcanza la sensibilidad y especificidad de la gammagrafía la cual está cercana al 100 %.11,20-23
El uso de métodos nucleares en el estudio del vaciamiento gástrico en seres humanos se remonta al año 1926, cuando Griffith y otros utilizaron alimentos marcados con Cr, por vía oral, y una gammacámara para cuantificar el tiempo de vaciado del estómago.21
El rastreo repetido con la gammacámara durante 4 h, luego de la ingesta de alimentos marcados, es considerado superior a otras técnicas diagnósticas ya citadas porque es el estudio más fisiológico de los disponibles para la evaluación de la función motora gástrica, no es invasivo y puede cuantificarse sin grandes complicaciones,9,19 además de que la dosis efectiva de radiación que reciben los pacientes es menor (0,89 mSv) comparada con la que reciben en un estudio por fluoroscopia (3 mSv). Sin embargo, sus resultados son dependientes del protocolo de adquisición y del alimento a ingerir, por eso se requiere un protocolo bien establecido y repetible.19-23
Técnica
Pueden utilizarse alimentos sólidos o líquidos marcados con 99mTc, en dependencia del objeto de estudio.24-27
La determinación de la motilidad para sólidos se logra mediante 99mTc-coloide de azufre, con actividad entre 7,4-60 MBq (0,2-1,5mCi), contenido en 2 huevos revueltos (esta comida es variable en los diferentes protocolos, pero esta variante es la más generalizada y fácil de realizar).
La determinación de la motilidad para líquidos se logra mediante 99mTc-coloide de azufre o DTPA (ácido dietilen triamino pentacético), en agua, jugo, leche, etc. con igual actividad a administrar. Este estudio en general se indica en niños.
Las premisas del desarrollo de estos estudios es la repetitividad de las comidas y su volumen, pues cualquier variación sobre el protocolo puede alterar los resultados del examen y su comparación con los valores de referencia.25-27
Los modos de adquisición
de las imágenes son variables. Para cuantificar el vaciamiento, algunos
autores realizan una adquisición dinámica, 1 imagen por minuto
durante 1 h y, posteriormente, se realiza una adquisición de 1 imagen
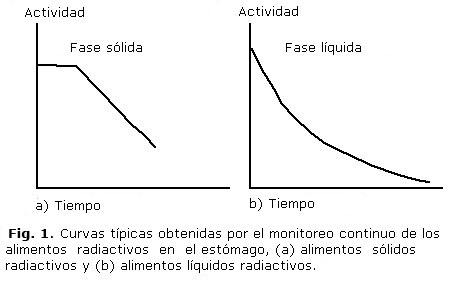
de 1 min a las 2, 3 y 4 h. Esto permite obtener una curva de actividad tiempo
en el estómago (Figs. 1 y 2).
Otros autores no realizan estudios dinámicos sino un seriado de imágenes a 0, 1, 2, 3 y 4 h, para cuantificar el contenido gástrico residual.27,28
El vaciado para sólidos es generalmente lineal con una fase de latencia (retardo) al principio (fig. 1a), mientras que el vaciado para líquidos es exponencial (fig. 1b). Ambos se pueden ajustar a una función matemática y calcular el tiempo medio de vaciamiento gástrico (fig. 2).
En la tabla se muestran los valores de referencia para el vaciado gástrico.
La mayoría de los autores plantean que el estudio con sólidos es más sensible para el diagnóstico de la gastroparesia, no obstante, algunos pacientes presentan un vaciamiento normal para los sólidos y un retardo del vaciamiento para los líquidos, por lo que otros recomiendan realizar ambos estudios.29
En el presente año, el Departamento de Medicina Nuclear del Hospital Clinico Quirúrgico "Hermanos Ameijeiras" comenzó a brindar el servicio para el estudio de la gastroparesia diabética por métodos gammagráficos, lo que permitirá una mejor atención y seguimiento de los pacientes diabéticos.
Se puede concluir que la gastroparesia diabética es un problema frecuente, poco diagnosticado, pero latente, que se debe investigar más por su repercusión sobre el control glucémico y sus consecuencias.
REFERENCIAS BIBLIOGRÁFICAS
1. Camilleri M. Clinical practice. Diabetic gastroparesis. N Engl J Med. 2007;356:8209.
2. Parkman HP, Camilleri M, Farrugia G. Gastroparesis and functional dyspepsia: excerpts from the AGA/ANMS meeting. Neurogastroenterol Motil. 2010;22:113-33.
3. Boas I. Diseases of the Stomach. 9th ed. Leipzig: Georg Thieme; 1925.
4. Kassander P. Asymptomatic gastric retention in diabetics: gastroparesis diabeticorum. Ann Intern Med. 1958;48:797-812.
5. Rundles RW. Diabetic neuropathy. Medicine. 1945;24:111-60.
6. Camilleri M, Bharucha A, Farrugia G. Epidemiology, Mechanisms, and management of Diabetic Gastroparesis. Clin Gastroenterol Hepatol. 2011;9:5-12.
7. Jung HK, Choung RS, Locke GR. The incidence, prevalence, and outcomes of patients with gastroparesis in Olmsted County, Minnesota, from 1996 to 2006. Gastroenterol. 2009;136:1225-33.
8. Schvarcz E, Palmer M, Ingberg CM, Aman J, Berne C. Increased prevalence of upper gastrointestinal symptoms in long-term type 1 diabetes mellitus. Diabet Med. 1996;13:478-81.
9. Bytzer P, Talley NJ, Leemon M, Young LJ, Jones MP, Horowitz M. Prevalence of gastrointestinal symptoms associated with diabetes mellitus: a population-based survey of 15 000 adults. Arch Intern Med. 2001;161:1989-96.
10.Talley NJ, Young L, Bytzer P. Impact of chronic gastrointestinal symptoms in diabetes mellitus on health-related quality of life. Am J Gastroenterol. 2001;96:716.
11. Ma J, Rayner CK, Jones KL, Horowitz M. Diabetic gastroparesis: diagnosis and management. Drugs. 2009;69:971-86.
12. Horowitz M, Jones KL, Akkermans LM. Gastric function. En: Horowitz M, Samson M, editores. Gastrointestinal Function in Diabetes Mellitus. Chichester: John Wiley & Sons Ltd. 2004;117:12-76.
13. Khoo J, Rayner CK, Jones KL, Horowitz M. Pathophysiology and management of gastroparesis. Expert Rev. Gastroenterol Hepatol. 2009;3:167-81.
14. He CL, Soffer EE, Ferris CD, Walsh RM, Szurszewski JH, Farrugia G. Loss of interstitial cells of cajal and inhibitory innervation in insulin-dependent diabetes. Gastroenterol. 2001;121:427-34.
15. Little TJ, Pilichiewicz AN, Russo A. Effects of intravenous glucagon-like peptide-1 on gastric emptying and intragastric distribution in healthy subjects: relationships with postprandial glycemic and insulinemic responses. J Clin Endocrinol Metab. 2006;91:1916-23.
16. Linnebjerg H, Park S, Kothare PA. Effect of exenatide on gastric emptying and relationship to postprandial glycemia in type 2 diabetes. Regul Pept. 2008;151:12-39.
17. Jones KL, Russo A, Berry MK, Stevens JE, Wishart JM, Horowitz M. A longitudinal study of gastric emptying and upper gastrointestinal symptoms in patients with diabetes mellitus. Am J Med. 2002;113:449-55.
18. Samsom M, Vermeijden JR, Smout AJ. Prevalence of delayed gastric emptying in diabetic patients and relationship to dyspeptic symptoms: a prospective study in unselected diabetic patients. Diabetes Care. 2003;26:3116-22.
19. Bharucha AE, Camilleri M, Forstrom LA, Zinsmeister AR. Relationship between clinical features and gastric emptying disturbances in diabetes mellitus. Clin Endocrinol (Oxf). 2009;70:415-20.
20. Abell TL, Camilleri M, Donohoe K. Consensus recommendations for gastric emptying scintigraphy: a joint report of the American Neurogastroenterology and Motility Society and the Society of Nuclear Medicine. J Nucl Med Technol. 2008;36:44-54.
21. Viramontes BE, Kim D-Y, Camilleri M. Validation of a stable isotope gastric emptying test for normal, accelerated or delayed gastric emptying. Neurogastroenterol Motil. 2001;13:567-74.
22. Haruma K, Kusunoki H, Manabe N. Real-time assessment of gastroduodenal motility by ultrasonography. Digestion. 2008;77(suppl 1):48-51.
23. Gentilcore D, Hausken T, Horowitz M, Jones KL. Measurements of gastric emptying of low- and high-nutrient liquids using 3D ultrasonography and scintigraphy in healthy subjects. Neurogastroenterol Motil. 2006;18:106-28.
24. Camilleri M, Bharucha AE, di Lorenzo C. American Neurogastroenterology and Motility Society consensus statement on intraluminal measurement of gastrointestinal and colonic motility in clinical practice. Neurogastroenterol Motil. 2008;20:1269-82.
25. Abell TL, Camilleri M, Donohoe K. Consensus recommendations for gastric emptying scintigraphy: a joint report of the American Neurogastroenterology and Motility Society and the Society of Nuclear Medicine. Am J Gastroenterol. 2008;103:753-63.
26. Knight LC, Kantor S, Doma S, Parkman HP, Maurer AH. Egg labeling methods for gastric emptying scintigraphy are not equivalent in producing a stable solid meal. J Nucl Med. 2007;48:1897-900.
27. Ziessman HA, Goetze S, Bonta D, Ravich W. Experience with a new standardized 4-hr gastric emptying protocol. J Nucl Med. 2007;48:56872.
28. Guo JP, Maurer AH, Fisher RS, Parkman HP. Extending gastric emptying scintigraphy from 2 to 4 hours detects more patients with gastroparesis. Dig Dis Sci. 2001;46:249.
29. Ziessman HA, Okolo P, Mullin G, Chander A. The added diagnostic value of liquid gastric emptying when solid emptying is normal. J Nucl Med. 2008;49(suppl 1):39.
Recibido: 10 de
abril de 2013.
Aprobado: 25
de abril de 2013.
Dr. Léster Rodríguez Paleo. Hospital Clínico Quirúrgico "Hermanos Ameijeiras". San Lázaro No. 701 entre Belascoaín y Marqués González. Centro Habana. La Habana, Cuba. CP 10 300. Correo electrónico: lesterrp@infomed.sld.cu