ARTÍCULO ORIGINAL
Niveles de hemoglobina glucosilada y su correlación con las glucemias de ayuno y postprandial en un grupo de pacientes diabéticos
Lays Rodríguez Amador, José Carlos Sosa Pérez, Emilio Fidel Buchaca Faxas, Francisco Fernández Valdés, Sergio Antonio Bermúdez Rojas, Isabel Mora
Hospital Clínico Quirúrgico Hermanos Ameijeiras. La Habana, Cuba.
RESUMEN
La diabetes es una epidemia que afecta a millones de personas en todo el mundo. Desde el surgimiento de la hemoglobina glucosilada, esta se ha convertido en el indicador más fiel del control glucémico de los pacientes con diabetes mellitus. Se realizó un estudio retrospectivo de una muestra de 129 pacientes diabéticos provenientes de la consulta protocolizada de diabetes mellitus del Hospital Hermanos Ameijeiras, con el objetivo de evaluar los niveles de hemoglobina glucosilada y determinar su correlación con las cifras de glucemia de ayuno y postprandial, así como establecer puntos de corte de glucemia de ayuno y postprandial para predecir cifras de HbA1c por encima de 7 %. El promedio general de HbA1c fue de 6,48 ± 2,228 %, y se encontró una correlación débil de las cifras de glucemia de ayuno y postprandial con las de HbA1c. El promedio general de la glucemia de ayuno fue de 8,420 mmol/L (r= 0,494; IC 95 %), y el de la glucemia postprandial de 10,531 mmol/L (r= 0,497; IC 95 %). Se concluye que la glucemia postprandial mostró mayor correlación con los niveles de HbA1c.
Palabras clave: diabetes; hemoglobina glucosilada; glucemia.
INTRODUCCIÓN
La diabetes mellitus (DM) es una enfermedad crónica de gran alcance epidemiológico, con una elevada prevalencia que ha aumentado progresivamente hasta alcanzar rasgos de epidemia. A lo largo del siglo XX se ha convertido en una de las enfermedades crónicas más importantes, afectando a más de 200 000 000 de personas en todo el mundo.1-4
El control glucémico es primordial en los pacientes diabéticos, en el cual se utilizan las determinaciones de glucemias de ayuno y postprandial, y de hemoglobina glucosilada. Pirart alertó en el sentido que el mal control glucémico acumulado durante años se asocia a una alta prevalencia e incidencia de retinopatía, nefropatía y neuropatía, y especialmente la retinopatía grave.5 A principios de la década de los noventa, el estudio Diabetes Control and Complications Trial (DCCT) en pacientes con diabetes tipo 1 y posteriormente el estudio United Kingdom Prospective Diabetes Study (UKPDS) en pacientes con diabetes tipo 2, demostraron que el control adecuado de la glucemia disminuye las complicaciones microvasculares de la diabetes6-8. Desde entonces, la hemoglobina glucosilada (HbA1c) se ha convertido en el "Gold Standard" para el manejo del control glucémico en los pacientes diabéticos.9-14
En el estado de hiperglucemia, se produce una excesiva interacción química de la glucosa con las proteínas, produciéndose la unión de ambas sin la necesidad de una intervención enzimática. Este proceso se ha denominado glucosilación no enzimática de las proteínas, y depende exclusivamente de la concentración de la glucosa y del tiempo de contacto de esta con las proteínas, influyendo además el tiempo de vida media de cada una de ellas.15 En la fase de glucosilación inicial o temprana se forma la base de Schiff, que es la aldimina inestable, la cual puede sufrir un reordenamiento intramolecular y transformarse en el compuesto de Amadori, que es más estable, y también es conocido como fructosamina (1-amino-1-desoxicetona); los niveles de fructosamina se correlacionan con los valores de hemoglobina glucosilada, por lo que puede ser una alternativa a la misma.16-21 Posteriormente ocurre la formación de los productos finales de la glucosilación avanzada, que son estables, e intervienen en las complicaciones de esta enfermedad.22-25
La hemoglobina glucosilada resulta de la unión de la glucosa a la molécula de hemoglobina. La hemoglobina humana está compuesta por tres variedades de hemoglobina: A (HbA) que representa más del 90 %; A2 (HbA2) que representa hasta un 3,5 % y la fetal, que representa hasta 1 % en la edad adulta.26 La HbA es un tetrámero no modificado, compuesto por 2 cadenas alfa y 2 cadenas beta, y constituye la forma mayor de la hemoglobina, también conocida como forma nativa. La HbA0 es el componente mayor de la HbA, identificado así por medio de sus propiedades cromatográficas y electroforéticas. Las hemoglobinas glucosiladas surgen por modificaciones postranscripcionales de la HbA0, debido a la unión de la glucosa a los residuos amino terminal de la valina de la cadena beta y épsilon amino de la lisina de las cadenas alfa y beta, formándose las hemoglobinas A1a, A1b y A1c, respectivamente.
La HbA1c es la más abundante de las fracciones menores de la hemoglobina en los eritrocitos humanos, y se forma por la adición estable de la glucosa al extremo N-terminal del aminoácido valina de la cadena β de la hemoglobina A constituyendo la N-1-Deoxyfructosyl beta hemoglobina, de lo cual se ha sugerido un cambio de denominación a DOF-Hb, el cual no ha sido adoptado.27,28 De esta forma, podemos decir que el organismo se encuentra expuesto a la modificación de su hemoglobina por la adicción de residuos de glucosa, por lo cual deducimos que, a mayor glucemia, mayor glucosilación de la hemoglobina.29
La glucosilación de la hemoglobina se produce lentamente y de forma permanente por la vía no enzimática, y debido a la permeabilidad del eritrocito, se relaciona con la concentración de glucosa en sangre; por lo tanto, la hemoglobina glucosilada representa el valor medio de glucemia en los últimos 90 a 120 días, tiempo de vida media del eritrocito.27 Los resultados descritos por Fitzgibbson en 1976 mostraron que las concentraciones de HbA1c se incrementan conforme el eritrocito envejece. En los diabéticos este incremento es significativamente mayor, en comparación con personas sanas.26,27 No obstante, para la interpretación de los resultados se advierte que la HbA1c no representa las concentraciones de glucosa durante los 120 días que tarda el proceso de glucosilación, ya que todo parece indicar que los cambios recientes en la glucemia se encuentran sobrerrepresentados en la hemoglobina glucosilada, porque los modelos teóricos y los estudios clínicos sugieren que un paciente tendrá el 50 % de su HbA1c formada en el mes previo a la toma de muestra: 25 % en el mes previo a esto y el 25 % restante en los meses 2 y 4, previos.30
En el mundo se han realizado diversos estudios que demuestran la relación entre los niveles de glucosa sanguínea con la hemoglobina glucosilada, para la cual los avances técnicos de los últimos años han mejorado la precisión hasta niveles comparables a los de la glucemia.50 Esto ha permitido además que sea utilizada para el diagnóstico de la DM.51-53 El estudio DCCT estableció una correlación entre la HbA1c y los niveles promedio de la glucemia.9 En este contexto nos preguntamos: ¿Cuáles serán los niveles de hemoglobina glucosilada y su correlación con los promedios de glucemias de ayuno y postprandial en los pacientes diabéticos atendidos en la consulta de protocolo de DM del Hospital Hermanos Ameijeiras.
El presente estudio tiene como objetivo conocer los niveles de hemoglobina glucosilada y su correlación con los promedios de glucemias de ayuno y postprandial en el grupo de pacientes estudiados.
MÉTODOS
Se confecciona un estudio retrospectivo de un grupo de pacientes diabéticos atendidos en la consulta de protocolo de DM del Hospital Hermanos Ameijeiras, con el propósito de determinar los niveles de hemoglobina glucosilada y su correlación con las cifras de glucemias de ayuno y postprandial, así como establecer puntos de corte de glucemias para predecir cifras de hemoglobina glucosilada por encima de 7 %, sin límite de edad, independientemente de si son diabéticos tipo 1 o tipo 2.
El universo estuvo conformado por los pacientes atendidos en la consulta protocolizada de DM del Hospital Hermanos Ameijeiras. La muestra se constituyó con 129 pacientes que cumplieron con los criterios:
Criterios de inclusión
Pacientes diabéticos previamente definidos.
Criterios de exclusión
Se excluyeron a pacientes con anemia hemolítica y enfermedad renal crónica, estados en los que el recambio de eritrocitos está aumentado, así como a pacientes con situaciones que interfieren en los resultados de la HbA1c como las hemoglobinopatías, esplenectomía, alcoholismo crónico, hiperbilirrubinemia, uremia, intoxicación por plomo y el empleo de salicilatos.
Definición de variables
Análisis estadístico
Se analizaron las variables seleccionadas mediante el cálculo de números absolutos y porcentajes (%) como medidas de resumen para variables cualitativas, la media y desviación estándar para variables cuantitativas.
Las cifras de HbA1c con las de glucemia de ayuno y postprandial de 2 h se correlacionaron mediante el coeficiente de correlación de Pearson, tomando un intervalo de confianza del 95 % para una asociación significativa si p< 0,05. La intensidad de la correlación se considera de acuerdo a la siguiente escala:
Para evaluar la capacidad de los valores medios de glucemia en ayuno y postprandial
en la predicción de cifras de HbA1c por encima de 7 %, se construyeron
curvas ROC (Receiver Operating Characteristic Curve) para cada caso.
El área bajo la curva fue el indicador utilizado para evaluar dicha capacidad.
Con los valores calculados de Sensibilidad y Especificidad se establecieron
puntos de corte.
RESULTADOS
Se estudiaron 129 pacientes, 59,7 % del sexo femenino y 40,3 % del sexo masculino, predominando las edades comprendidas entre 60 y 69 años, en 35,7 %, seguido de los pacientes de 70 años y más, en un 24 %.
La muestra se conformó con 8 diabéticos tipo 1 (6,2 %) y 121 diabéticos tipo 2 (93,8 %), con un tiempo de evolución medio conocido de la enfermedad de 9,65 ± 9,690 años.
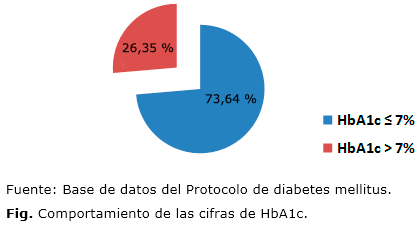
El promedio general de HbA1c fue de 6,48 ± 2,228 %. Se evidenció que el 73,64 % de los pacientes mostraron cifras de HbA1c menores o iguales a 7 %, mientras que el 26,35 % mostraron cifras mayores a 7 % (Fig.).
La tabla 1 muestra la distribución de los niveles
de HbA1c y los promedios de las glucemias de ayuno y postprandial.
Se encontró una correlación débil de los niveles de glucemias de ayuno y postprandial con las cifras de HbA1c, con un promedio general de la glucemia en ayunas de 8,420 mmol/L (r= 0,494; IC 95 %), y un promedio general de la glucemia postprandial de 10,531 mmol/L (r= 0,497; IC 95 %). La glucemia postprandial presentó mayor correlación que la glucemia de ayuno, con las cifras de HbA1c (tabla 2).
Se contrastaron las cifras de glucemias de ayuno y postprandial, con las cifras
de hemoglobina glucosilada (HbA1c) por encima de 7 %, para determinar el área
bajo la curva. Se empleó una curva ROC, con intervalo de confianza de 95
% (tabla 3).
La tabla 4 ilustra el análisis de diferentes valores
de glucemia de ayuno, combinando la sensibilidad y la especificidad para pronosticar
cifras de hemoglobina glucosilada por encima de 7 %, a través de una curva
ROC. El punto de corte que mejor predice esta cifra es de 8,02 mmol/L (S= 67
y E= 68) (Área bajo la curva: 0,69).
La tabla 5 ilustra el análisis de diferentes valores
de glucemia postprandial, combinando la sensibilidad y la especificidad para
pronosticar cifras de hemoglobina glucosilada por encima de 7 %, a través
de una curva ROC. El punto de corte que mejor predice esta cifra es de 10,2
mmol/L (S= 79 y E= 66) (Área bajo la curva: 0,76).
DISCUSIÓN
El análisis de los niveles de hemoglobina glucosilada y su correlación con los promedios de glucemias en un grupo de pacientes diabéticos protocolizados en el Hospital Hermanos Ameijeiras de La Habana, constituye una investigación de interés práctico, debido a que nos permite tener una aproximación al grado de correlación existente entre las glucemias de ayuno y postprandial con las cifras de HbA1c, lo cual facilita un mejor manejo de nuestros pacientes, en cuanto a la valoración del control glucémico, y a la toma de decisiones desde el punto de vista terapéutico.
La HbA1c está disponible comercialmente como prueba de laboratorio para uso clínico desde finales de la década de los 70,31-34 y no fue hasta la década de los 90 cuando se demostró su utilidad con los estudios DCCT y UKPDS.6-8 Nuestro país cuenta con el reactivo y la tecnología para llevar a cabo determinaciones de HbA1c desde hace más de 20 años, lo cual ha sido de gran importancia en la práctica asistencial e investigativa en el campo de la diabetes.35,36
En muchos países de la región y de otros continentes existe el inconveniente para medir la hemoglobina glucosilada a todos los pacientes diabéticos, y para realizarle a estos por lo menos una medición al año, debido a la poca disponibilidad del examen y a la falta de reactivo. Es conocido que en los Estados Unidos sólo el 24 % de los diabéticos tienen una medición anual de HbA1c.37 En Cuba actualmente esta prueba no se practica en todas las provincias; es por ello que el alcance de los resultados de este estudio no nos permite más que divulgarlos, debido a que no se pueden efectuar comparaciones nacionales para determinar el grado de correlación con otras poblaciones de diabéticos.
A nivel global es conocido el predominio de la DM en personas mayores de 60 años, lo cual está relacionado con un aumento de la expectativa de vida y a una mayor exposición a factores de riesgo para esta enfermedad, como los hábitos dietéticos inadecuados, el sedentarismo, la obesidad, entre otros.38 Nuestro país no dista de esta realidad, debido a que el envejecimiento de la población cubana ha contribuido al aumento de la morbilidad por DM, predominando los pacientes mayores de 60 años.39,40 De igual forma intervienen los factores de riesgo como el sedentarismo y la obesidad, el sobrepeso, y los malos hábitos dietéticos, predominantemente el consumo de grasa animal y carbohidratos, y el bajo consumo de frutas y vegetales, que son frecuentes en nuestra población.41 En nuestro estudio el 59,7 % de los pacientes superaban los 60 años de edad, lo cual se correlaciona con lo enunciado anteriormente. Se ha documentado que la HbA1c aumenta aproximadamente 0,1 % cada 10 años de edad, lo cual es poco significativo como para establecer un cambio en las metas de tratamiento para los diferentes grupos etarios.42
Se evidenció un predominio de las mujeres sobre los hombres en el grupo de pacientes de 60 años y más, en 64,9 % y 35 % respectivamente, lo cual corresponde con lo reportado en la literatura extranjera43 y nacional.44 Este predominio del sexo femenino está determinado por la mayor longevidad de las mujeres, y por diferencias en la distribución de factores de riesgos como la dieta, el sedentarismo, entre otros.
Predominaron los pacientes con buen control glucémico, lo cual se justifica con el hecho de ser pacientes protocolizados, que asisten periódicamente a la consulta. De los 129 pacientes de la muestra, 95 de ellos mostraron cifras de HbA1c menores o iguales a 7 % (el 73,64 %), mientras que los 34 pacientes restantes mostraron cifras de HbA1c mayores de 7 % (el 26,35 %). El promedio general de HbA1c fue de 6,48 ± 2,228 %.
Las cifras que prevalecieron de HbA1c oscilan entre 4 % y 9 %, por lo cual empleamos este rango de valores para establecer las correlaciones correspondientes con las glucemias de ayuno y postprandial. Este rango estrecho está determinado por el escaso tamaño de la muestra estudiada, y por predominar los casos controlados, debido a que son pacientes protocolizados, lo cual se expresó con un escaso número de pacientes con HbA1c mayores de 9 %. Otros estudios han empleado rangos mayores de HbA1c; tal es el caso de la ADA,45 que asciende hasta cifras de 12 %, y el DCCT,9 que asciende hasta el 14 %.
Al correlacionar los valores de HbA1c con los promedios de glucemias en nuestros pacientes, se establecieron comparaciones con otros estudios, y se evidenció que las correlaciones de HbA1c con los promedios de glucemia de ayuno en nuestro grupo son diferentes a los estándares internacionales que propone la ADA,45,46 siendo generalmente menores los promedios de glucemias de nuestro estudio. No obstante, estos valores son similares a los obtenidos por el DCCT.6
En un estudio realizado en nuestro país en 1986 se correlacionaron los niveles de HbA1c de 74 pacientes,47 con los promedios de glucemias de ayuno, encontrándose una elevada correlación en los pacientes que no empleaban insulina, y una correlación más débil en los que empleaban insulina, siendo esta última resultado del mejor control glucémico que presentaban los pacientes.
Se encontró una correlación débil de los niveles de HbA1c con los promedios de glucemias de ayuno y postprandial, en lo cual influye también el escaso número de la muestra, y el predominio de los casos controlados. Es importante destacar que se obtuvo mayor correlación de la HbA1c con las cifras de glucemia postprandial, en comparación con la glucemia de ayuno, lo cual se ha observado en pacientes con cifras de HbA1c cerca del rango normal, en donde se encuentra la gran mayoría de los pacientes de nuestra muestra. Es importante esta información sobre las cifras de glucemia postprandial, pues se ha descrito que los picos de hiperglucemia pueden aumentar el estrés oxidativo y activar la proteína kinasa C, favoreciendo la aparición de complicaciones crónicas.48
Diferentes sociedades científicas en todo el mundo han adoptando valores de HbA1c como objetivos del control glucémico, aunque no siempre en el mismo nivel. Así, la Federación Internacional de Diabetes49 en el 2005 propuso cifras < 6,5 %, al igual que la ALAD50 en 2007 para América Latina. En 2008 el Instituto Nacional de Excelencia Clínica en el Reino Unido51 adoptó cifras entre 6,5 y 7,5 %; mientras que la Sociedad Canadiense de Diabetes52 en 2008 propuso cifras ≤ 7 %, y la Sociedad Española de Diabetes53 en 2008, cifras < 7 %. En 2012 la ADA46 propone como objetivo de control glucémico cifras de HbA1c menores de 7 %, para los adultos diabéticos en general; debido a que un promedio de 7 % ha demostrado reducir las complicaciones microvasculares y posiblemente las macrovasculares de la diabetes.
Se han realizado diversos estudios correlacionando los valores de HbA1c con los promedios de glucemia, y estableciendo puntos de corte de esta para predecir determinados valores de HbA1c. Así, El-Kebbi et al54 arrojó que una glucemia basal venosa de 165 mg/dL (9,16 mmol/L) predecía una HbA1c > 8 %, con sensibilidad de 79 % y especificidad de 78 %. El estudio Bouma et al87 evidenció que una glucemia venosa basal de 140 mg/dL (7,7 mmol/L) tiene una sensibilidad de 90 % y especificidad de 66 % para predecir una HbA1c > 7 %, con un coeficiente de correlación de 0,77. En nuestro estudio se empleó una curva ROC, con intervalo de confianza de 95 %, para establecer puntos de corte que predicen HbA1c > 7 %, y se demostró que una cifra de glucemia de ayuno de 8,02 mmol/L, predice una HbA1c > 7 %, con sensibilidad de 67 % y especificidad de 68 % (Área bajo la curva: 0,69), en tanto que una cifra de glucemia postprandial de 10,2 mmol/L predice una HbA1c > 7 %, con sensibilidad de 79 % y especificidad de 66 % (Área bajo la curva: 0,76). Teniendo en cuenta estos resultados, se determina que la glucemia postprandial predice mejor dichas cifras de HbA1c, con respecto a la glucemia de ayuno. Esto es de gran interés práctico en la consulta, a la hora de interpretar los valores de glucemias de ayuno y postprandial, y tener una aproximación sobre los niveles de HbA1c y del control glucémico de cada paciente.
El advenimiento de la HbA1c ha superado la confiabilidad de la mayoría de los equipos de salud en las determinaciones de la glucemia en ayunas, debido a que la HbA1c estima los niveles de glucemias en los últimos 120 días, independientemente de las variaciones de estas en este periodo y de los factores que influyan en la adherencia de un paciente al tratamiento. Es por ello que debemos promover el empleo de la HbA1c como examen capital en la evaluación del control glucémico, y mantener la glucemia como un examen coadyuvante y no determinante, para el manejo del paciente diabético.
Estos resultados pueden motivar a dar continuidad a este estudio, empleando un mayor número de pacientes, e incluyendo además a pacientes que no lleven seguimiento en la consulta protocolizada de diabetes mellitus, lo cual nos permitirá tener una mejor aproximación al comportamiento de las cifras de HbA1c en nuestros pacientes diabéticos, así como establecer las correlaciones de esta con las cifras de glucemias.
CONCLUSIONES
Las correlaciones entre los valores de HbA1c y las cifras de glucemia de ayuno y postprandial son débiles, por lo cual estas deben considerarse orientativas, y no sustitutivas de la HbA1c. La glucemia postprandial presenta mayor correlación con los niveles de HbA1c, en comparación con la glucemia de ayuno. La glucemia postprandial predice mejor una HbA1c > 7 %, con respecto a la glucemia de ayuno.
REFERENCIAS BIBLIOGRÁFICAS
1. White F. La importancia del consenso en la prevención y el control de la diabetes en América Latina y el Caribe. Visión Méd. 1997;20:13-6.
2. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates and projections. Diabetes Care. 1998;21:1414-31.
3. International Diabetes Federation. Atlas of diabetes extract [Internet]. 2003 [cited 2014 Nov 14]. Available from: http://www.eatlas.idf.org/media
4. Wild S, Roglic G, Green A, Sicree R, King H. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care. 2004;27:1047-53.
5. Pirat J. Diabetes mellitus and its degenerative complications: a prospective study of 4400 patients observed between 1947 and 1973. Diabetes Care. 1978;1:168-88;252-63.
6. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977-86.
7. UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998;352:837-53.
8. UK Prospective Diabetes Study Group. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS35). BMJ. 2000;321:405-12.
9. Effect of intensive diabetes management on macrovascular events and risk factors in the diabetes control and complications trial. Am J Cardiol 1995;75:894-903.
10. Turner RC. The U.K. prospective diabetes study. A review. Diabetes Care. 1998;21(Suppl 3):C35-8.
11. Standards of medical care for patients with diabetes mellitus. Diabetes Care 2000;23(Suppl 1):S32-42.
12. Standards of medical care in diabetes. Diabetes Care 2005;28(Suppl 1):S4-S36.
13. Standards of medical care in diabetes-2007. Diabetes Care 2007;30(Suppl 1):S4-S41.
14. Standards of medical care in diabetes-2008. Diabetes Care 2008;31(Suppl 1):S12-54.
15. Actis SM, Rebolledo OR. La glicación y glicooxidación de las lipoproteínas. Su importancia en la diabetes mellitus. Rev Med Buenos Aires. 2000;60:645-6.
16. Lim HS. Fructosamine and diabetes. Singapore Med J 1988;29:541-3.
17. Sera RA, García M, Moreira R. Glicación de proteínas como elemento esencial en las complicaciones crónicas de la diabetes mellitus. Rev Cis Méd Hab. 2001;7:1-9.
18. Setter SM. Biochemical pathways for microvascular complications of diabetes mellitus. Ann Pharmacother. 2003;37:1858-66.
19. Kalousova M, Zima T, Tesar V, Dusilova-Sulkova S, Skrha J. Advanced glycoxidation end products in chronic diseases-clinical chemistry and genetic background. Mutat Res. 2005;579:37-46.
20. Valdiguié P. Fisiopatología de las complicaciones reumatológicas de la diabetes. L´Observatoire du Mouvement. 2006;7:1-3.
21. Youssef D, El Abbassi A, Jordan RM, Peiris AN. Fructosamine-an underutilized tool in diabetes management: case report and literature review. Tenn Med. 2008;101:31-3.
22. Soca PEM, Bahr AP, Niño S. Mecanismos moleculares del daño microvascular de la diabetes mellitus. Correo Cientif Méd Hol. 2004;8:1-11.
23. Obregón O, Vecchionacce H, Brito S, Lares M, Castro J, Ramírez X, et al. Efecto antiglicosilante de las vitaminas E y C. Arch Venez Farmacol Terap. 2005;24:1-10.
24. Gebel E. A hypothesis for the AGEs. Exploring the link between high blood glucose and diabetes complications. Diabetes Forescast. 2010;63:52-5.
25. Méndez JD, Xie J, Aguilar M, Méndez V. Trends in advanced glycation end products research in diabetes mellitus and its complications. Mol Cell Biochem [Internet]. 2010 [cited 2014 Nov 14]. Available from: http://www.springerlink.com/content/wmg173j7w459u483/
26. Jenkins M, Ratnaike S. Capillary electrophoresis of hemoglobin. Clin Chem Lab Med. 2003;41:747-54.
27. Iglesias P, Díez JJ. Glucación no enzimática de proteínas en la diabetes mellitus. Med Clin (Barc). 1997;108:23-33.
28. Fitzgibbons JF, Koler RD, Jones RT. Red-cell age-related changes of hemoglobins AIa+b and AIc in normal and diabetic subjects. J Clin Invest 1976;41:820-4.
29. Bunn HF, Haney DN, Kamin S, Gabbay KH, Gallop PM. The biosynthesis of human hemoglobin A1c. Slow glycosylation of hemoglobin in vivo. J Clin Invest 1976;57:1652-9.
30. Goldstein DE, Little RR, Wiedmeyer HM, et al. Glycated hemoglobin: methodologies and clinical applications. Clin Chem 1986;32(10 Suppl):B64-70.
31. Gonen B, Rubenstein A, Rochman H, Tanega SP, Horwitz DL. Haemoglobin A1: an indicator of the metabolic control of diabetic patients. Lancet 1977;2:734-7.
32. Davis JE, McDonald JM, Jarett L. A high-performance liquid chromatography method for hemoglobin A1c. Diabetes 1978;27:102-7.
33. Beccaria L, Chiumello G, Gianazza E, Luppis B, Righetti PG. Hemoglobin A1C separation by isoelectric focusing. Am J Hematol 1978;4:367-74.
34. Poynard JP, Malgrange D, Couchot J, Caron J, Leutenegger M, Maquart FX, et al. Dosage par micromethode de l’hemoglobine A1c chez les diabetiques. Premiers resultats. Nouv Presse Med 1978;7:1648-9.
35. Ezcurra EJ. Montaje y estandarización de la determinación calorimétrica de hemoglobina glicosilada. Rev Cubana Med. 1986;25:660-6.
36. Ezcurra EJ. La hemoglobina glicosilada y su importancia en la práctica asistencial e investigativa en el campo de la diabetes mellitus. Revisión bibliográfica. Rev Cubana Med. 1986;25:592-602.
37. Fuscaldo C, Calzada L, Estrada Y, Salazar S, Monge S, Artavia E, Figueroa V et al. La calidad del control del paciente diabético en Costa Rica. AMC 2000;42:205.
38. Eschwege E. Epidemiology of type II diabetes, diagnosis, prevalence, risk factors, complications. Arch Mal Coeur Vaiss. 2000;93(4):13-1.
39. Anuario estadístico de Cuba 2008. La Habana: Oficina Nacional de Estadísticas; 2008. Disponible en: http://www.one.cu/aec2008/datos/19.18.xls
40. Rodríguez A, Álvarez L. Repercusiones del envejecimiento de la población cubana en el sector salud. Rev Cubana Salud Púb. 2006;32:178-82.
41. Cooper RS, Orduñez P, Iraola MD, Bernal JL, Espinosa-Brito A. Cardiovascular disease and associated risk factors in Cuba: prospects for prevention and control. Am J Public Health. 2006;96:94-101.
42. King H, Aubert RE, Herman WH. Global burden of diabetes, 1995-2025: prevalence, numerical estimates, and projections. Diabetes Care. 1998;21:1414-31.
43. Pani LN, Korenda L, Meigs JB, Driver C, Chamany S, Fox CS, et al. Effect of aging on A1c levels in individuals without diabetes: evidence from the framingham offspring study and the national health and nutrition examination survey 2001-2004. Diabetes Care. 2008;31:1991-6.
44. Seuc AH, Domínguez E, Díaz O. Esperanza de vida ajustada por diabetes. Rev Cubana Endocrinol [Internet]. 2003 [citado 14 Nov 2014];14(3). Disponible en: http://scieloprueba.sld.cu/scielo.php?script=sci_arttext&pid=S1561-30032005000200006&lng=es&nrm=iso
45. American Diabetes Association. Standards of medical care in diabetes-2008. Diabetes Care. 2008;31(Suppl 1):S12-54.
46. American Diabetes Association: Standards of medical care in diabetes 2012 (Position Statement). Diabetes Care 35(Suppl 1):S76-S80.
47. Ezcurra Ferrer EJ. Correlación entre niveles glicémicos y concentración de hemoglobina glicosilada en pacientes diabéticos. Rev Cubana Med 1986;25(11):1104-10.
48. Buse JB, Hroscikoski M. The case for a role for postprandial glucose monitoring in diabetes management. J Fam Pract. 1998 Nov;47(5 Suppl)S29-36. PMID: 9834753.
49. International Diabetes Federation. Clinical Guidelines Task Force. Guía global para la diabetes tipo 2. Bruselas [Internet]. 2006 [citado 14 Nov 2014]. Disponible en: http://www.idf.org/webdata/docs/GGTD%20Spanish%20Fi
50. Asociación Latinoamericana de Diabetes. Guías ALAD de diagnóstico, control y tratamiento de la diabetes mellitus tipo 2[Internet]. Washington DC: Organización Panamericana de la Salud; 2007 [citado 14 Nov 2014]. Disponible en: www.paho.org/mex/index.php?option=com_docman&task
51. National Collaborating Centre for Chronic Conditions.Type 2 diabetes: National clinical guideline for management in primary and secondary care (update) [Internet]. London: Royal College of Physicians; 2008 [cited 2014 Nov 14]. Disponible en: http://www.nice.org.uk
52. Committee. Canadian D iabetes Association 2008 clinical practice guidelines for the prevention and management of diabetes in Canada. Can J Diabetes. 2008;32(suppl 1):1-201.
53. Documento 2005 de consenso entre varias sociedades científicas sobre pautas de manejo del paciente diabético tipo 2 en España. Av Diabetol [Internet]. 2005 [citado 14 Nov 2014];21(S1). Disponible en: www.sediabetes.org/gestor/upload/revistaAvances/21-supl-1.pdf
54. El-Kebbi IM, Ziemer DC, Gallina DL, Phillips LS. Diabetes in urban african-americans VI. Utility of fasting or random glucose in identifying poor glycemic control. Diabetes Care 1998;21:501-5.
Recibido: enero
de 2015.
Aprobado:Abril de 2015.
Dra. Lays Rodríguez Amador. Hospital
Clínico Quirúrgico Hermanos Ameijeiras. La Habana, Cuba.
Correo electrónico: medint@hha.sld.cu